Proteini kristallere büyütme Teach article
Tercüme eden: Aslı Giray Kurt ve Hikmet Geckil (İnönü Üniversitesi, Biyoloji Bölümü, Malatya). İsviçre Zürih Üniversitesi’nden Beat Blattmann ve Patrick Sticher, protein kristallografisinin temelini oluşturan bilimi açıklıyor ve bilim adamları tarafından protein…

milimetreden daha küçük ve
gelişimi zor olan küçük ve
narin nesnelerdir. Oysa
protein kristalleri, X ışınları
ile analiz edilen yapısal
biyolojik çalışmalar için
gereklidir
Resim, Gaby Sennhauser,
University of Zürich izniyle
1959 yılında, Max Perutz ve John Kendrew, balina hücrelerinde oksijen taşınımından sorumlu, küçük bir protein olan balina miyoglobininin üç boyutlu yapısı hakkında bir makale yayımladılar. Bu iki bilim adamı protein yapısının araştırılması ile ilgili olarak, moleküler düzeyde oksijen taşıma mekanizmasını anlamayı istiyorlardı. Araştırmacılar, proteinin kristallerini büyüttüler ve X ışını analizi ile kristalin kırınım motifine bağlı olarak yapısını belirlemeye çalıştılar.
Perutz ve Kendrew balina miyoglobin kristalleri ile kullanışlı kırınım motifini elde edene kadar, daha önce diğer türlerden bir dizi miyoglobini test etmişlerdi. Bu öncü çalışma, 1962w1 yılında Kimya dalında Nobel Ödülü’ne layık görüldü. Ancak 50 yıl sonra bile, yapısal çalışmalar için protein kristalleri elde etmek hala önemli bir sorun olarak durmaktadır.
Proteinler nedir?
Proteinler canlı hücrelerde sulu olmayan bileşenlerin en büyük grubudur. Hemen her biyokimyasal reaksiyon, enzim olarak adlandırılan belirli bir protein gerektirir. Proteinlerin diğer tipleri mekanik ve yapısal (ör.,bağ dokusundaki kolajen) veya hücre sinyalini düzenlemede (ör., hormon reseptörleri) immün cevap (ör., antikorlar) ya da küçük moleküllerin taşınımı (ör., iyon kanalları) gibi işlevlere sahiptir. Bu çeşitlilik oldukça geniştir: sadece insanda 20,000’den fazla farklı proteinin var olduğu bilinmektedir.
Bu çeşitliliğe rağmen, tüm proteinler benzer bir yapısal prensibi paylaşırlar. Proteinler amino asit olarak adlandırılan 20 farklı yapıtaşından oluşurlar. Amino asitler birbirlerine kovalent bağlarla bağlanarak düz bir zincir oluştururlar (bkz. aşağıdaki Şekil). Protein zincirinin uzunluğu birkaç düzine amino asitten binlerce amino asite kadar olabilir. Hücrelerde her protein, ona karşılık gelen gelen gen tarafından kodlanır. Proteinin sentezi karmaşık bir moleküler makine olan, protein ve RNA’dan oluşan ribozom tarafından yapılır.
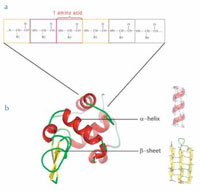
oluşturmak için birbirine
kovalent olarak bağlanan
amino asitlerden oluşur
b. Proteinler, kendi işlevlerini
belirleyen üç boyutlu bir
yapıya katlanırlar. Amino asit
zincirinin belli bölgeleri
karakteristik katlanmalar
gösterir. Bu katlanmalara iki
önemli örnek α-heliksler ve
β-tabakalarıdır.
Büyütmek için resmin üzerini
tıklayınız
Image courtesy of Marc
Leibundgut, ETH Zürich, and
www.pdb.org
Proteinler kendilerine özgü üç boyutlu yapılara katlanırlar
Normal koşullar altında amino asitlerden oluşan lineer zincirler belli üç boyutlu yapılara kendiliğinden katlanırlar. Amino asitlerden oluşan zincirin belli bölgeleri karakteristik sekonder yapılı elementler oluştururlar. Bu elementler arasında en önemlileri tipik olarak amino asitler arasında hidrojen bağları ile kurulan α- heliks ve β- tabakalı yapılardır (bkz. aşağıdaki Şekil). Proteinin tamamı böyle çeşitli yapısal elementlerin oluşturduğu bir üçüncül (tersiyer) yapıyı oluşturur.
Yapı, işlevdir: Bir proteinin üç boyutlu yapısı bize neyi anlatır?
Belli bir proteinin fonksiyonu onun üç boyutlu yapısına bağlıdır. Bir protein sadece katlandığında, proteinin belirli amino asitleri aktif bölgeyi oluşturacak şekilde biri birine yeterince yakın gelirler. Enzimlerde olduğu gibi bu bölgeler biyokimyasal reaksiyonları katalizleyebilir veya antikorlarda olduğu gibi spesifik bir bağlanma bölgesi oluşturabilirler. Yaşamın temel süreçlerinin moleküler seviyede nasıl işlediğini anlamak için bir proteinin yapısal detaylarının araştırılması büyük önem taşır: yapısal biyolojinin araştırma alanı budur. Bugün yapısal biyolojinin önemli hedeflerinden biri, büyük makromolekül komplekslerinin ve zar proteinlerinin etkileşim, yapı ve işlevlerinin aydınlatılmasıdırw2. Karmaşıklıkları nedeniyle, bu proteinlerin deneysel olarak çalışılması ve yapılarının belirlenmesi son derece zordur. Bu tür bir işi yapmak her zaman büyük bir başarı olarak addedilmiştir. Ancak, bu kompleks proteinler temel biyolojik süreçlerde gerekli oldukları için, yapı ve fonksiyonlarının anlaşılması için bunlara büyük bir ilgi vardır ve bilim adamları bunları kristalize etmeyi denemeye devam etmektedirler.
Resim, Beat Blattmann ve Patrick Sticher’in izniyle
Proteinler doğrudan gözlem için çok küçüktürler
Proteinler, yalnızca birkaç nanometre ile ölçülen (1 nm = 1x 10-6 mm) küçük yapılardır, Bu parçacıklar bu boyutları ile 1 mikrometrelik maksimum çözünürlüğe sahip güçlü ışık mikroskobu ile bile gözlemlenemezler (1 mikron = 1x 10-3 mm). Protein yapılarını ‘görünür’ yapmak için üç önemli teknoloji kullanılır:
- Protein kristallerinin X-ışını kırınımı
- Nükleer manyetik rezonans (NMR)
- Elektron kristalografisi
Halka açık biyolojik makromoleküllerin veritabanındaw3 bulunan tüm proteinlerin %90’ından fazlasının yapısı X-ışını kırınımı ile belirlendiğinden, bu yöntem üzerinde özellikle duracağız. Kristallografinin tarihi hakkında daha fazla bilgi edinmek ve yapısı çözülene kadar bir laboratuvardan başka bir laboratuvara bir proteinin yolculuğunu öğrenmek için Dominique Cornuéjol’nun bu sayıdaki makalesine bakınız..
Proteinlerin kristalleşmesi oldukça hünerli bir iştir, çünkü her yeni proteini kristalize edecek uygun koşulları belirlemek zor olup hatta bazen imkansızdır. Böylece tekrarlanabilir kristal kalitesini sağlamak için (yani, aynı derecede iyi kristallerin tekrar büyütülmesi) bilim adamları kontrollü deneyler kurarlar. Protein kristalografisi içinde en sık kullanılan yöntem buhar difüzyon yöntemidir (bkz. Şekil): bu yöntemde, bir kristalizasyon solüsyonunun küçük bir miktarı rezervuarın kristalizasyon haznesine eklenir. Protein solüsyonu ve kristalizasyon solüsyonunun bir damlası bu haznenin merkezinde bulunan bir damlanın üzerine pipetlenir.
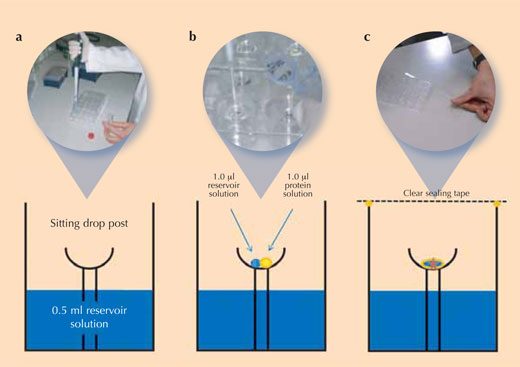
Resim, Beat Blattmann ve Patrick Sticher’in izniyle
Tüm solüsyonlar ekledikten sonra buharlaşmayı önlemek için hazne mühürlenir. Kristalizasyon solüsyonunda tuz iyonlarının konsantrasyonu haznenin merkezinde bulunan damladakinden daha yüksek olduğu için, gaz fazında buhar difüzyonu ile çözücü (solvent) moleküller protein damlasından rezervuara doğru hareket ederler. Bu işlem sırasında, damladaki proteinin çözünürlüğü azalır. Sonunda aşırı doymuş hale gelen protein solüsyonu termodinamik olarak kararsız durumdur. Bu durum, damladaki proteinin bir kısmının sonuçta daha büyük kristallerle büyümesini sağlayan kristal çekirdeği oluşturmasına (bkz. Resim) veya X ışını analizinde kullanışsız amorf bir proteini çökeltisine neden olur. Kristalizasyon ve çöktürme birbiriyle yarış halinde olan süreçlerdir. Bu yüzden istenem kristalizasyonla sonuçlanacak optimal koşulları tespit etmek son derece önemlidir.
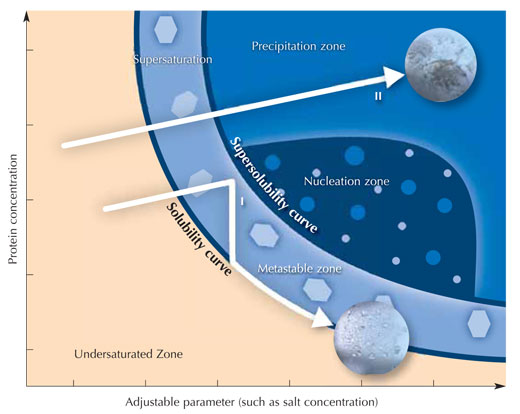
Resim, Nicola Graf’ın izniyle
Sınıfta lizozim kristalleri
Bu pratik etkinlikte öğrenciler bir protein için optimal kristalizasyon koşullarını belirleyerek X ışını kristalografisi hakkında daha fazla bilgi edinirler. Öğrenciler pH ve tuz konsantrasyonunun bir fonksiyonu olarak lizozim kristallerinin oluşumunu araştırırlar.
Lizozim
Lizozim, bakteriyel hücre duvarına hasar veren anti-bakteriyel enzimlerin ailesine ait bir proteindir. İnsanlardagözyaşı, tükürük ve mukus gibi bir dizi salgıda bol miktarda bulunmaktadır. Lizozimin büyük bir miktarlarda tavuk yumurtası akında da bulunabilir.
Malzeme ve materyal
- Sınıf başına bir veya iki Cryschem™ kristalizasyon tabağı (Hampton Araştırma)
- Kristal berraklığında sızdırmayan bant (5 cm) (Hampton Araştırma)
- 1 ml ve 1 μl’lik pipetler
- Kristalleri gözlemlemek için bir mikroskop
- 20 °C’de depolama kabini
Kimyasallar
- Lizozim (Sigma-Aldrich Ürün # 62971, BioChemika derecesinde) – lizozimi farklı bir kaynaktan da kullanılabilir. Ancak, bu protokol için başarılı bir şekilde test edildiğiiçin yukarıdaki marka tavsiye edilir)
- Sodyum klorür (NaCl) (süpermarketteki sofra tuzu da aynı işi görür)
- Sitrik asit
- Sodyum asetat
- Sodyum fosfat, tek bazlı
- Sodyum hidroksit çözeltisi
- Glasiyel asetik asit
- Deiyonize su (DI-su)
Stok solüsyonları
Aşağıdaki sulu stok solüsyonları öğretmen tarafından önceden hazırlanmış olmalıdır:
- Su içinde hazırlanmış 50 mg / ml lizozim stok solüsyonu
- 3 M sodyum klorür
(100 ml DI-suda 17.53 g NaCl çözünür)
- 1 M sodyum sitrat, pH 3.5
(100 ml DI-suda 19.24 g sitrik asit çözünür ve sodyum hidroksit çözeltisi ile pH 3.5’e ayarlanır).
- 1 M sodyum asetat, pH 4.5
(100 ml DI-suda 13.6 g sodyum asetat çözünür ve glasiyel asetik asit ile pH 4.5’e ayarlanır)
- 1 M sodyum asetat, pH 5.5
(100 ml DI-suda 13.6 g sodyum asetat çözünür ve glasiyel asetik asit ile pH 5.5’e ayarlanır)
- 1 M sodyum fosfat, pH 6.5
(100 ml DI-suda 15.6 g sodyum fosfat çözünür ve sodyum hidroksit çözeltisi ile pH 6.5’e ayarlanır).
Kristal büyütme deneyi
- Kristalizasyon deneyleri için stok solüsyonlarından, tabloya göre 24 rezervuar çözeltisi hazırla. Öğrenciler küçük gruplar halinde ayrılabilir ve her bir grup bu 24 farklı çözeltinin birkaçını hazırlar. Tüm gruplar aynı stok çözeltilerini kullanabilir.
- Referans olarak tabloyu kullanarak, bir Cryschem ™ tabağının 24 rezervuarlık kuyusunun her birinin içine, ona karşılık gelen rezervuar çözeltisinden 0.5 ml pipetlenir (yukarıdaki şekilde ‘a’). Tablo, her bir şartı özetler ve plaka üzerindeki kuyuların pozisyonunu gösterir.
- Rezarvuar solüsyonundan 1 μl kristalizasyon kabında bulunan her damlanın üzerine ilave ediniz (yukarıdaki şekilde ‘b’)
- Her rezervuar solüsyon damlasının 1 μl’ sine lizozim stok solüsyonundan 1 μl ekleyin (yukarıdaki şekilde ‘b’).
- Protein solüsyon damlasını ekledikten sonra buharlaşmayı önlemek için hemen şeffaf sızdırmaz bant ile kristalizasyon damarını kapatın (yukarıdaki şekilde ‘c’)
- Plakayı 20 ° C’de sakla. Bazı kuyularda kristaller hemen büyümeye başlar ve 1-2 saat aralıklarla büyüme doğrudan mikroskop altında görülebilir. Plakalar son analiz için, sonraki derste kadar saklanabilir. Yaklaşık 1-2 hafta sonra kristal, nihai boyutuna büyümüş olacaktır. “A” işaretli plaka bir yıl kadar hatta bazen daha uzun devam edecektir.
- Lizozim kristallerinin sayısı, büyüklüğü ve dağılımı analiz edilir. Kristaller, çıplak gözle görülemeyecek kadar cok küçük olabilir. Bu nedenle iyi bir büyüteç yada mikroskop çok daha yararlı olacaktır.
- 24 rezervuar sonucunun karşılaştırılmasıyla kristalizasyon için uygun koşullar belirlenir.
| 1 | 2 | 3 | 4 | 5 | 6 | ||
|---|---|---|---|---|---|---|---|
| 2.0 ml, 3M NaCl stok solüsyonu (son kons. 0.6 M) 7.0 ml DI-su |
3.0 ml, 3M NaCl stok solüsyonu (son kons. 0.9 M) 6.0 ml DI-su |
4.0 ml, 3M NaCl stok solüsyonu (son kons.. 1.2 M) 5.0 ml DI-su |
5.0 ml, 3M NaCl stok solüsyonu (son kons. 1.5 M) 4.0 ml DI-su |
6.0 ml, 3M NaCl stok solüsyonu (son kons. 1.8 M) 3.0 ml DI-su |
7.0 ml,3M NaCl stok solüsyonu (son kons. 2.1 M) 2.0 ml DI-su |
||
| A | 1.0 ml sodyum sitrat(son kons. 0.1 M), pH 3.5 | A1 | A2 | A3 | A4 | A5 | A6 |
| B | 1.0 ml sodyum asetat(son kons. 0.1 M), pH 4.5 | B1 | B2 | B3 | B4 | B5 | B6 |
| C | 1.0 ml sodyum asetat(son kons. 0.1 M), pH 5.5 | C1 | C2 | C3 | C4 | C5 | C6 |
| D | 1.0 ml sodyum fosfat(son kons. 0.1 M), pH 6.5 | D1 | D2 | D3 | D4 | D5 | D6 |
X ışını ile kristalleriniz ölçüldü mü?
Sınıfınız protein kristallerini başarıyla büyüttü ise Dr Patrick Sticher sticher@bioc.uzh.ch adresinden sizinle iletişim kurmaktan memnun olacaktır. İsviçre NCCR (Araştırmada Yeterlilik Ulusal Merkezi) Yapısal Biologyw2 bu protokolü kullanarak protein kristallerini başarıyla büyüten ilk 10 okulun için bir X-ışını kırınımı görüntüsü üretmeyi teklif etmiştir. X-ışını ölçümleri hem doğrudan okul örneklerinden, veya postalama bir sorun ise sınıfınız tarafından belirlenen optimize kristalizasyon şartları kullanılarak büyütülen kristaller üzerinde yapılabilir. Bilim adamları da kırınım görüntüleri ile birlikte, bu bilgilerin proteinin gerçek yapısını elde etmek için gelecekte nasıl kullanılacağı konusunda bilgi verirler ve gerekirse bir sertifika verirler.
Bilim adamları ile sohbet edin
Öğrenciler, kendi deneylerini yaptıktan sonra Skypew4, aracılığıyla bilim adamları ile, çevrimiçi sohbet edebilirler. Randevu almak için, Patrick Sticher (sticher@bioc.uzh.ch) e-posta adresinden” proteincrystallography” Skype hesabını kullanarak onunla sohbet edebilirsiniz.
Ek öğretim materyali indiriniz
Powerpoint slayt, resim ve daha fazla deney çevirimiçiw5 mevcuttur.
Malzeme tedarikçileri
Aşağıdaki tedarikçilerw6 gerekli malzemeleri ve kimyasalları sağlar:
Hampton Araştırma:
- Cryschem™ 24-1 SBS plaka, Cat. No HR1-002 (Bu tür plaka kullanmanızı öneririz. Bir plakanın maliyeti yaklaşık olarak 3$ Amerikan doları).
- Kristal Şeffaflıkta Sızdırmaz Bant (5 cm), Cat. No HR4-51
Gilson Inc:
- 1 ml ve 1 μl pipetler
Sigma Aldrich:
- Lizozim, Ürün #62971
- Sodyum klorür, Ürün #71380
- Sitrik asit, Ürün #27488
- Sodyum asetat, Ürün #71190
- Sodyum fosfat, tek bazlı, Ürün #71502
References
- Cornuéjols D (2009) Biological crystals: at the interface between physics, chemistry and biology. Science in School 11: 70-76. www.scienceinschool.org/2009/issue11/crystallography
Web References
- w1 – Kimya dalında 1962 Nobel ödüllü sahipleri ve onların öncü çalışmaları hakkında ek bilgi, Nobel Ödülü Komitesi web sitesinde bulunabilir: http://nobelprize.org/nobel_prizes/chemistry/laureates/1962
- w2 – İsviçre Araştırmada Mükemmeliyet Ulusal Merkezi (NCCR) Yapısal Biyoloji, zar proteinleri ve supra-moleküler komplekslerinin yapı-işlev ilişkilerinin aydınlatılmasına kendilerini adamış bilim adamlarının oluşturduğu bir topluluktur: www.structuralbiology.uzh.ch
-
Seçilmiş araştırma sonuçlarına buradan ulaşabilirsiniz: www.structuralbiology.uzh.ch/research004.asp
-
- w3 – Biyolojik makromoleküllerin yapıları (proteinler ve nükleik asitlerin) Protein Veri Bankasında (PDB) mevcuttur. Web sitesi ilginç öğretim kaynakları sunmaktadır: www.pdb.org
-
Protein bilgileri için diğer değerli bir kaynak: www.proteopedia.org
-
- w4 – Skype yüklemek ve kaydetmek için, bkz: www.skype.com
- w5 – AEk ders kaynaklarına şu adresten ulaşabilirsiniz: www.structuralbiology.uzh.ch / teacher: www.structuralbiology.uzh.ch/teacher
-
Login: crystallization
-
Password: xraybeam2008
-
This site will be updated regularly.
-
- w6 – malzeme tedarikçilerinin web siteleri aşağıdaki gibidir:
-
Hampton Araştırma: www.Hamptonresearch.com
-
Gilson Inc.: www.gilson.com
-
Sigma-Aldrich: www.sigmaaldrich.com
-
Resources
- Abad-Zapatero C (2002) Crystals and Life: A Personal Journey. La Jolla, CA, USA: International University Line. ISBN: 978-0972077408
- Burada, daha genç öğrencilere protein olmayan kristalleri büyütmek için önerilen bazı protokoller:
Review
Bu makale, X-ışını kırınımı ile protein kristalleri çalışma için iyi bir giriş niteliğindedir. Bu anlamda, biyoloji, fizik, kimya gibi – üç bilim için ilginç bir egzersiz sunmakta ve üç bilim arasındaki bağları göstermektedir. Küçük şeylere nasıl bakıldığını, ve neden bu seviyedeki şeyleri çalışmaya gerek duyulduğunu tartışmaktadır. Makalede ayrıca analitik bir araç olarak kırınım kullanımının farkında olmayan öğretmenler için iyi bir okuma zemini sağlar.
Pratik deneyi kurmak ve sonuçları elde etmek biraz zaman alacak gibi görünüyor, fakat sonuçların bir üniversitede değerlendirilecek olması, diğer pratik çalışmalarımıza farklı bir boyut kazandırıyor.
Mark Robertson, İngiltere





