Stabil och långsam frisättning, stor effekt: ett nytt spännande material för långtidsverkande läkemedel Understand article
Informationen nedan är baserad på en artikel från ILL News.
Forskare har utvecklat ett molekylärt administrationssystem för kontinuerlig frisättning av ett HIV-läkemedel.

Minns du senast du tog ett läkemedel? Det var förmodligen i form av en tablett. Men vad är det egentligen som händer med läkemedlet i din kropp efter att du svalt det?
När tabletten kommer ner i magen bryts den ner för att frisätta de medicinskt aktiva molekylerna som behandlar din sjukdom. De här molekylerna transporteras genom magsäckens väggar in till ditt blodomlopp. Blodet transporterar sedan läkemedlet genom din kropp så att det når de organ där det behövs.
Till en början kommer läkemedelsnivån i blodet att öka. Med tiden kommer läkemedlet att brytas ner av din kropp och så småningom utsöndras, vilket innebär att dess nivåer kommer att sjunka igen. Du kan se denna ökning och minskning i figur 1.
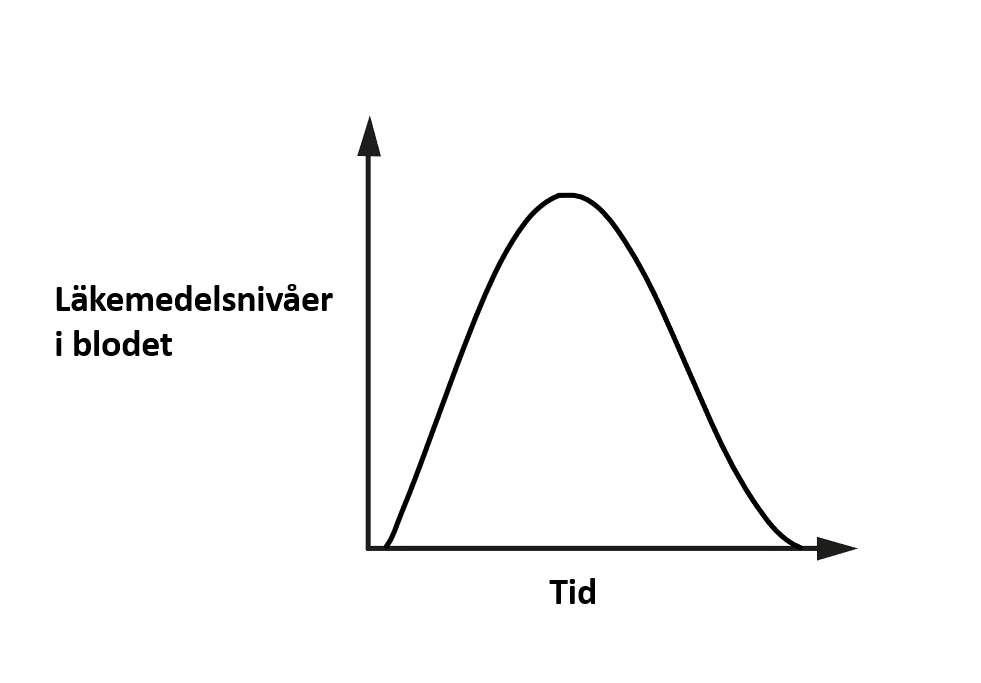
Bild används med tillstånd från upphovsmannen
När mängden i blodet faller under en viss nivå blir läkemedlet inte längre effektivt. Höga halter måste dock undvikas eftersom läkemedel också kan ge skadliga biverkningar. Till exempel paracetamol, som används för att behandla smärta och feber, kan skada levern vid höga doser. Det är därför väldigt viktigt att noggrant kontrollera läkemedelsnivåerna i blodet.
Faktum är att det finns ett specifikt dosintervall som motsvarar den mängd läkemedel som är tillräckligt hög för att bota sjukdomen, men inte så pass hög att den skadar kroppen. Det här intervallet kallas för ”terapeutiskt fönster” (se figur 2). Om vi har i åtanke att läkemedelsnivåerna ökar och minskar efter att du har tagit tabletten, som beskrivits ovan, ser vi att läkemedelsnivåerna i blodet endast är inom det terapeutiska fönstret under en ganska kort tid.
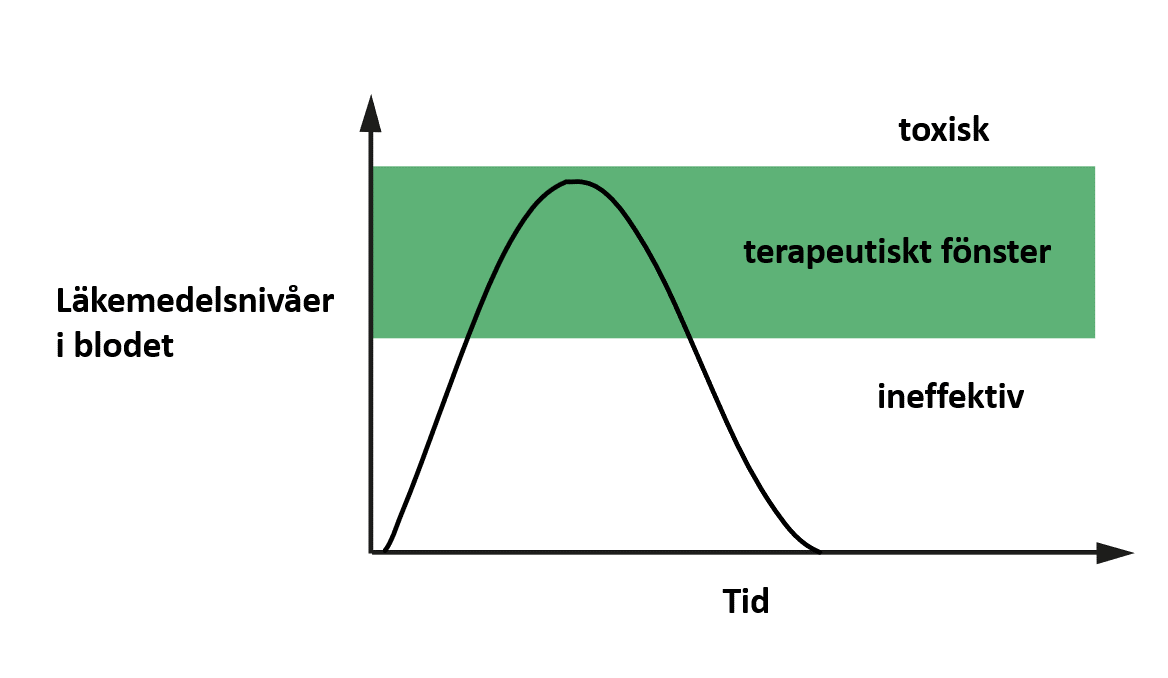
Bild används med tillstånd från upphovsmannen
En central fråga är: hur kan vi förlänga tidsintervallet då läkemedelsnivån är inom det terapeutiska fönstret, så att den avsedda sjukdomen kan behandlas under en längre tid?
Det finns två alternativ: du kan ta en högre dos av läkemedlet eller ta det oftare. Det leder till att läkemedelsnivåerna i blodet kommer att likna dem som visas i figur 3. En stor enstaka dos kan öka läkemedelsnivåerna i blodet till en toxisk nivå, men att behöva ta flera doser upprepade gånger kan lätt leda till att doserna glöms bort.
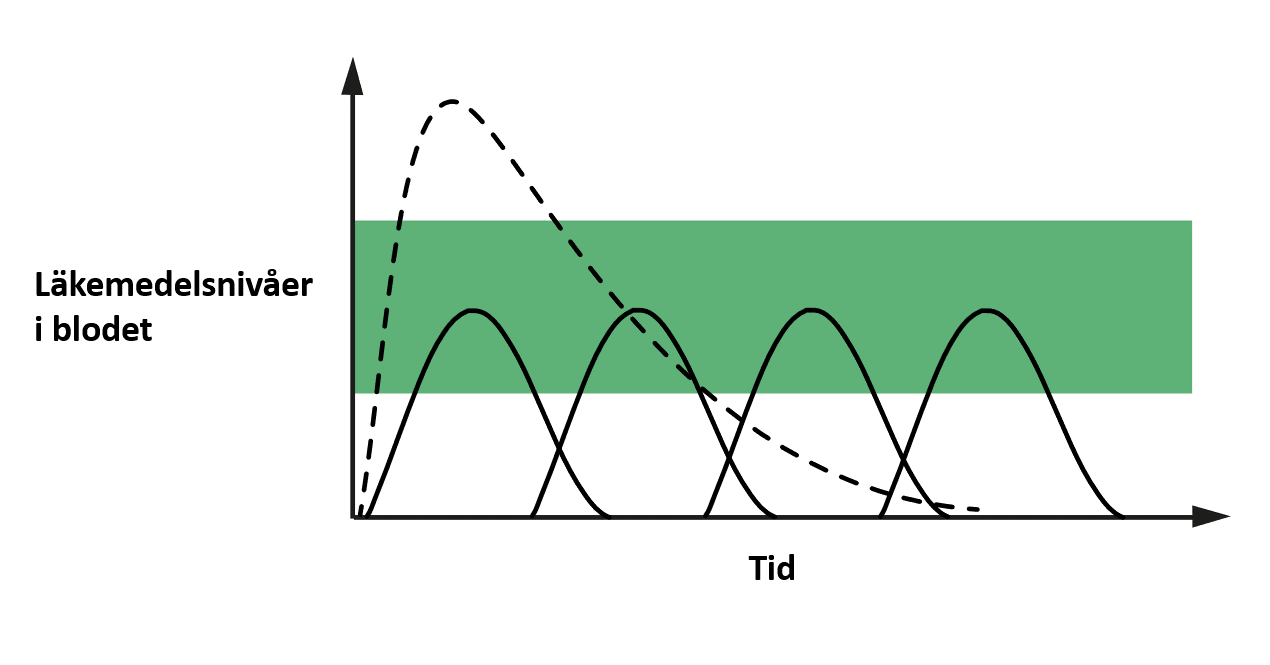
Bild används med tillstånd från upphovsmannen
För personer infekterade med humant immunbristvirus (HIV), som kan orsaka förvärvat immunbristsyndrom (AIDS), är det här en särskild utmaning. För att hålla viruset under kontroll är det väldigt viktigt att upprätthålla läkemedelsnivån inom det terapeutiska fönstret hela tiden. Det innebär att HIV-patienter måste ta tabletter varje dag. Alla klarar inte av att följa en så strikt behandlingsplan, vilket kan leda till en ineffektiv behandling med allvarliga konsekvenser för hälsan.
En väldigt bra lösning på det här problemet skulle vara ett administrationssystem som frisätter HIV-läkemedlet långsamt och kontinuerligt ut i blodomloppet (figur 4).
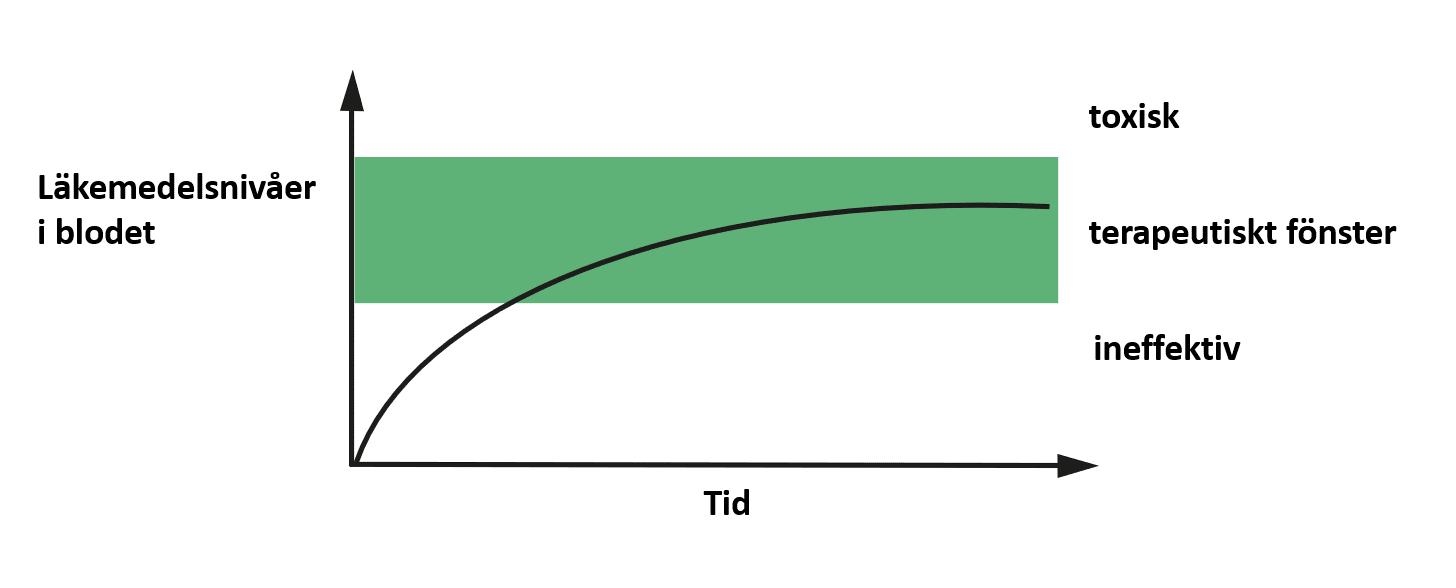
Bild används med tillstånd från upphovsmannen
Forskare har tidigare utvecklat sådana administrationssystem baserade på peptider (korta kedjor som består av aminosyror). De peptider som bär på läkemedlet injiceras under huden, där enzymerna arrangerar dem till en ”molekylär depå” i form av en hydrogel – ett nätverk av peptider som innehåller vatten. Läkemedlet frisätts sedan långsamt från hydrogelen. Olyckligtvis bryts peptider ner ganska snabbt av enzymerna i kroppen (figur 5, gula figurer). I syfte att förbättra dessa administrationssystem har forskare designat en ny typ av hydrogel som består av en blandning av peptider och peptoider (syntetiska molekyler som liknar peptider men har en annan kemisk grupp i stället för protonen på kväveatomen i peptidbindningen). En av peptoidernas fördelar är att de inte känns igen lika lätt av de enzymer som bryter ner peptiderna, vilket innebär att peptoider är stabilare i kroppen (figur 5, höger).
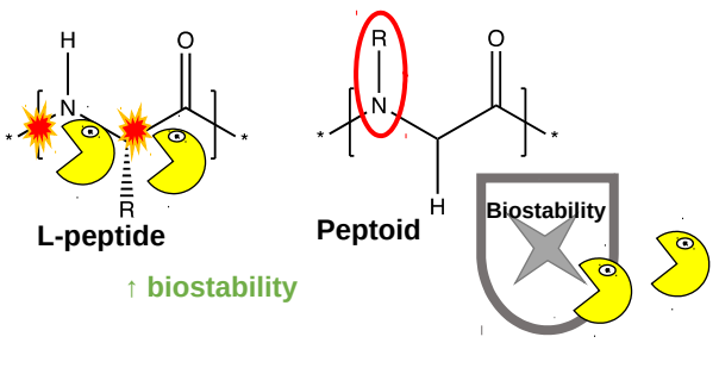
Bild anpassad från Ref. [1]
Den nya strukturen av peptoider och peptider binds till HIV-läkemedlet (zidovudin, som förkortas AZT) och har modifierats kemiskt för att kunna innehålla en fosfatgrupp. Gruppen förhindrar att ett gelnätverk bildas tills peptoidpeptidsystemet injiceras i huden där fosfatasenzymer tar bort difosfatgruppen, vilket leder till att en gel snabbt bildas. Gelnätverket hydrolyseras sedan över tid och frisätter läkemedlet långsamt och kontinuerligt ut i blodomloppet (figur 6).
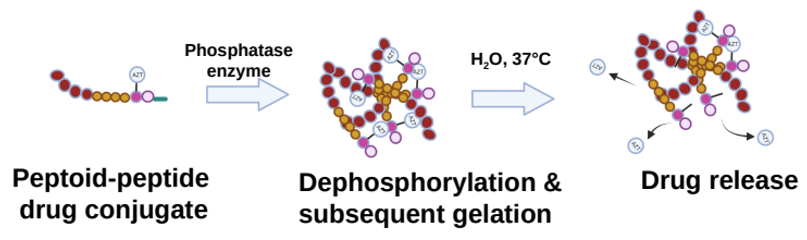
Bild anpassad från Ref. [1]
Det är viktigt att förstå den mikroskopiska strukturen hos hydrogelen för att optimera dess förmåga att frisätta AZT och få rätt dos. Först erhölls detaljerade bilder av hydrogelerna genom att använda mikroskopitekniker med hög upplösning (figur 7). Bilderna visar att hydrogelerna består av tredimensionella svampliknande nätverk av peptoidfibrer.

Bild anpassad från Ref. [1]
Samtidigt som mikroskopi ger en ögonblicksbild av en specifik längdskala av hydrogelerna kan andra tekniker ge detaljerad information om flera längdskalor samtidigt. En sådan teknik är småvinkelspridning av neutroner (SANS).
Neutronforskning
Neutroner är partiklar som vanligtvis finns i atomkärnan. Fria neutroner för experiment (som SANS) måste produceras av specialiserade spallationskällor eller neutronreaktorer. En sådan reaktor finns vid Laue-Langevin-institutet (ILL) i Grenoble, Frankrike.

© A Chezière/ILL
Neutroner som produceras av kärnreaktorn på ILL är en kraftfull metod för att undersöka mindre prover av material. De har speciella egenskaper som gör det möjligt att ge information som ofta är omöjlig att få fram med andra tekniker. Neutronerna interagerar med materiens atomkärnor och genom att observera hur de böjer av och ändrar hastighet får man exakt information om kärnans position och rörelse. Med hjälp av specialiserade instrument riktas neutronstrålar mot prover, som hydrogelerna som beskrivits här. Proverna sprider en del av neutronerna som registreras i en speciell detektor. Genom att analysera antalet neutroner som spridits i olika vinklar kan forskare förstå den molekylära strukturen och egenskaperna hos proverna. Neutronerna interagerar starkt med väte och svagare med isotopen deuterium (”tungt väte”). Om en del av vätet i proverna byts ut mot deuterium kan utvalda delar av provet framhävas för ännu mer detaljerade undersökningar.
SANS visade att den molekylära strukturen hos peptoidhydrogelerna förblir densamma oavsett om de innehåller AZT eller inte. Det här innebär att fibrernas egenskaper har en större inverkan på nätverkets övergripande struktur än själva tillsatsen av läkemedlet. Det innebär också att nätverkets struktur inte rubbas av läkemedlet.
Studier visade att den nya peptoidhydrogelen frisatte AZT under en period på 28 dagar i teströr. Ytterligare experiment visade att den absorberades i kliniskt relevanta mängder i en djurmodell i över 35 dagar. Dessa resultat visar att hydrogelerna är en väldigt bra mall för utvecklingen av långtidsverkande administrationssystem för läkemedel. Den här tekniken förväntas vara lika effektiv för behandling av flera andra sjukdomar, som cancer, malaria och tuberkulos. En annan fördel med de här administrationssystemen är att de kan leverera läkemedel till kroppsdelar som ofta är svåra att komma åt, som ögonen eller det centrala nervsystemet.
Författarens tack
Det här arbetet har utförts av forskare från Researchers from Queen’s University i Belfast med finansiering från Wellcome Trust och Engineering and Physical Sciences Research Council (EPSRC) i Storbritannien.
References
[1] Coutler SM et al. (2024) In Situ Forming, Enzyme-Responsive Peptoid-Peptide Hydrogels: An Advanced Long-Acting Injectable Drug Delivery System. Journal of the American Chemical Society 146: 401–21 416. doi: 10.1021/jacs.4c03751
Resources
- Läs mer om Institut Laue-Langevin
- Inspirerande lärarresurser inom partikelfysik hittar du hos Accelerate Your Teaching: Lewis J (2024) Accelerate your teaching with links to cutting-edge science. Science in School 67.
- Bygg en Gauss-kanon för att demonstrera linjär acceleration och spallation: Lewis J, Michalak L (2024) Build a linear accelerator model. Science in School 67.
- Prova några aktiviteter för att utforska och lära dig om partikelacceleratorer nära dig: Lewis J, Darve C (2024) Accelerators are everywhere, perhaps closer than you think…. Science in School 69.
- Prova den här rollspelsaktiviteten för att undervisa dina studenter om synaptisk överföring: Andersen-Gassner M, Möller A (2023) Hold your nerve: acting out chemical synaptic transmission. Science in School 63.
- Lär dig hur fysiker studerar väldigt små och väldigt stora objekt: Akhobadze K (2021) Exploring the universe: from very small to very large. Science in School 55.
- Prova den här rollspelsaktiviteten för att förstå hur forskningsprojekt finansieras och varför grundläggande forskning är viktig: McHugh M et al. (2022) What is it good for? Basic versus applied research. Science in School 55.
- Läs om magnetiska bakterier och deras potential för medicinsk tillämpning: ILL (2020) Insights into magnetic bacteria may guide research into medical nanorobots. Science in School 51.
- Lär dig om vikten av djuranvändning i forskning och några banbrytande metoder för att begränsa den: Schmerbeck S et al. (2021) Organ-on-chip systems and the 3Rs. Science in School 54.
- Lär dig om användningen av protonstrålning för cancerterapi: Welsch CP (2021) Death Star or cancer tumour: proton torpedoes reach the target. Science in School 55.
- Upptäck hur antikroppar från kameler kan förändra den medicinska vetenskapen: Hammarén M (2024) Inspired by camelids: nanobodies are a magnificent molecular velcro. Science in School 70.
- Lär dig om hur kosmisk strålning från rymden kan påverka elektroniken på jorden: ILL (2023) What does particle physics have to do with aviation safety? Science in School





