En ny syn på ljus: bygg din egen spektrometer Teach article
Översatt av Per Kornhall. Ta en vanlig CD och ett flingpaket; vad blir det? Med lite hjälp från Mark Tiele Westra så blir det din alldeles egna spektrometer! Det är dags att utforska skönheten i de färger som finns dolda i de mest vardagliga ting omkring oss.
Astronomy Observatory/
Association of Universities for
Research in Astronomy/
National Science Foundation
Vitt ljus är egentligen inte vitt – det består av en mängd olika färger. Ljusets sammansättning – dess spektrum –studeras med hjälp av en spektrometer. I den här artikeln beskriver vi hur man kan bygga sin egen fullt fungerande spektrometer med hjälp av i princip ingenting annat än ett flingpaket och en CD. Vi kommer att använda det hemmagjorda instrumentet för att låta oss förvånas av den fantastiska värld av färger som döljer sig bland vardagsföremål som glödlampor, ljusrör, dataskärmar och stearinljus. Låt oss börja upptäcka!
Hur man kan dela upp ljus
Det finns olika sätt att dela upp på ljus på. Ett sätt är att använda ett prisma, som Newton gjorde. På grund av variationer i refraktionsindex så kommer olika färger att gå olika vägar genom prismat, vilket får ljuset att dela upp sig.

av ytan på en CD-skiva
Bild från Mark Tiele Westra
Ett annat sätt är at använda ett så kallat diffraktionsgitter, vilket består av ett stort antal smala paralella spår, se bild nedan.
Interaktionen mellan de smala spåren och ljuset leder till att de färgerna blir reflekterade i olika riktningar.
Det är väldigt praktiskt att alla har högkvalitativt diffraktionsgitter hemma: CD-skivor. Regnbågsfärgerna som uppträder på ytan av en CD är en klar indikation på att de kan fungera som refraktionsgitter. Men varför? Illustrationen ovan visar hur en CD-skiva skulle se ut i hög förstoring. Musiken är kodad genom långa eller korta gropar som är placerade i ett långt spiralspår på ytan. Spåren, som har ett avstånd mellan sig som är bara 1,6 µm (1600 nm), fungerar som ett gitter.
Hur man bygger en flingpakets-spektrograf
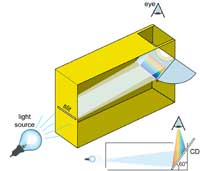
flingpakets-spektrometer.
CD:n placeras i 60° vinkel
mot botten av flingpaketet
Bild: Mark Tiele Westra
Vi kan använda sådana här hushålls-diffraktions-gitter för att konstruera vår egen spektrometer. Den består av två viktiga delar: en CD, som delar upp ljuset och en small springa på den andra sidan av flingpaketet som skapar en tunn ljusstrimma.
Springan, ljusinsläppet, görs på den ena sidan av paketet med hjälp av tjockt papper och tejp. En lite mer avancerad modell kan göras med hjälp av två rakblad som tejpas med eggarna mot varandra, som visas på bilden. Om springan är för bred blir spektrumet suddigt och om den är för smal så blir det för ljussvagt. En bredd på 0,2 mm verkar fungera bra, man kan experimentera med olika bredder. Kvaliteten på spektrumet hänger på kvaliteten på springan så den bör konstrueras med noggranhet.
På den andra sidan av paketet monteras en oinspelad CD med 60° vinkel mot botten av paketet. På ovansidan öppnas ett hål genom vilket spektrumet kan observeras. Ströljus elimineras genom att alla hål och öppningar kring CD-skivan täcks med svart tejp.
För att observera ett spektrum så pekar man med springan (ju närmare desto bättre) mot en ljuskälla och tittar genom öppningen ner på CD-skivan. Man kan behöva titta i olika vinklar för att få en känsla av hur spektrumet fungerar. Vill man fotografera spektran går det bra med en vanlig digitalkamera med makrofunktion. Bäst resultat får man med manuellt fokus, eftersom kameran kan ha svårt att hitta fokus på på ett spektrum med autofokusfunktionen.
Mätningar

Bild: Mark Tiele Westra

Bild: Mark Tiele Westra
Dags att experimentera! Vårt första försök blir att titta på ett spektrum från en vanlig glödtrådsglödlampa. Resultatet syns nedan.
Vi ser ett snyggt kontinuerligt spektrum med alla regnbågens färger. I en glödlampa produceras ljuset av en väldigt het tunn metalltråd.
Nu vänder vi blicken istället istället till två fluorescerande ljuskällor som båda sänder ut vad vi upplever som vitt ljus.
Den första, som är ett vanligt lysrör, uppvisar ett spektrum som består av ett antal skarpa linjer mot en bakgrund av ett kontinuerligt spektrum. De här emissionslinjerna (se nedan) produceras av kvicksilverångor inne i röret. Kvicksilvret producerar också ultraviolett ljus som omvandlas till ett kontinuerligt spektrum av ett tunt lager av fosfor på insidan av röret.
Nästa lysrörslampa uppvisar ett väldigt annorlunda spektrum. Anledningen är att tillverkarna kan variera färgen på ljuset genom att använda olika kombinationer av fosfor. Lampan på bilden nedan använder ett fosfor som emitterar ett kontinuerligt spektrum, men den här typen använder så kallat trefärgsfosfor: En kombination av tre sorters fosfor som var och en har sin egen uppsättning av emissionslinjer. Vi uppfattar den resulterande mixen av färger som vitt ljus.
En liten del av ett tomt textdokument på en bärbar dators skärm ger spektrumet som visas nedan. De tre pixelfärgerna som skapar bilden syns tydligt – rött, grönt och blått.

Bild: Mark Tiele Westra

Bild:Mark Tiele Westra
Hur spektra bildas
En del av de spektra som kan ses med flingpaketsspektrometern har en kontinuerlig bakgrund med färger som förändras jämnt från mörk rött till mörkt blått. Andra består av skarpa linjer mot en kontinuerlig bakgrund åter andra av skarpa linjer utan bakgrund, eller till och med mörka linjer mot en kontinuerlig bakgrund, som i solens spektrum (se nedan). Varför? Hur bildas spektra?

ljuslåga producerar en
natriumemissionslinje
Bild: Mark Tiele Westra
Allt beror på atomerna. En enstaka atom kan befinna sig i olika energinivåer beroende på om dess elektroner uppehåller sina normala banor, orbitaler, eller om de har blivit exciterade till högre sådana. Atomer kan inte ha vilka energinivåer som helst: nivåerna är väldigt specifika och bestäms av detaljer i atomstrukturen. När en elektron hoppar från en nivå till en annan, så motsvarar skillnaden i energinivåerna precis den energi som frigörs i form av en foton. Energin i den utsända fotonen bestämmer dess färg.
Eftersom flera olika hopp är möjliga så kan varje atom emittera vissa bestämda färger av ljus. Om dessa färger separeras med ett prisma eller ett gitter så blir varje emitterad färg synlig som en emissionslinje i det som kallas ett linjespektrum.
För att demonstrera hur en emissionslinje bildas kan vi titta på vad som händer om vi stoppar in lite vanligt koksalt (natriumklorid, NaCl) i en låga från ett vanligt stearinljus. Den övre högra bilden nedan visar det kontinuerliga spektrumet från ljuslågan, som liknar ett spektrum från en glödlampa. När vi tar lite salt på en kniv och sätter in det i lågan uppträder en distinkt orange linje i spektrumet, en linje som korresponderar med emissionslinjen från natrium (Na, vid 589 nm).
En atom inte bara sänder ut ljus utan den absorberar också ljus av samma våglängd som den emitterar. Om ljus passerar igenom en kall gas av atomer med låg densitet så absorberar den specifika frekvenser, vilket orsakar mörka linjer i spektrumet som kallas absorbtionslinjer.
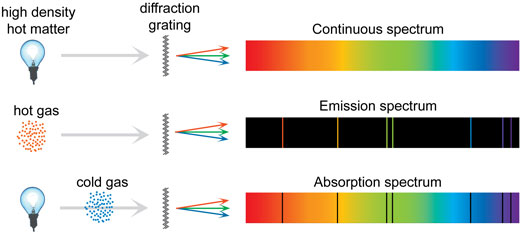
Bild: Mark Tiele Westra
Men om alla spektra bildas genom att atomer emitterar väl definierade färger, hur bildas då kontinuerliga spektra? För en ensam atom opåverkad av yttre omständigheter så är verkligen linjerna i dess spektrum skarpt. Detta är vad som händer i en gas under lågt tryck som i t.ex ett lysrör. I en gas under högre tryck som i solen och i flytande och fasta ämnen så sker det så många kollisioner mellan partiklar och andra händelser som gör att linjerna blir suddiga vilket leder till ett kontinuerligt spektrum. De tre olika typerna av spektra summeras i bilden nedan.
Olika atomer (och molekyler) har olika emissions- och absorptionsspektra. Den här skillnaden kan man utnyttja; bara genom att titta på ljuset som kommer från en avlägsen stjärna eller solen så kan vi avgöra vilka kemiska ämnen som finns i ljuskällan. På jorden används den här metoden genom att man lyser genom ämnen, (ofta en gas) och mäter dess absorptionsspektrum. På så vis kan man bestämma provets sammansättning.
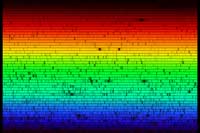
Solens spektrum
Om vi tar ut vår spektrometer utomhus så kan vi se solljusets spektrum. Spektrumet, som kan ses nedan, ser kontinuerligt ut vid första anblicken. Men om vi tittar närmare kan vi se att det finns flera mörka linjer, linjer som bildas genom absorption av specifika våglängder av ljus i solens yttre lager och i jordens atmosfär. Bilden nedan ger inte full rättvisa till flingpaketsspektrometern, med blotta ögat är spektrumet mycket tydligare.
Absorbtionslinjerna som vi observerar i solens spektrum har ett namn: Fraunhoferlinjer. Joseph von Fraunhofer (1787-1826) var den förste som systematiskt studerade och mätte det här fenomenet även om han inte var den förste som observerade dem. Totalt kartlade han 570 linjer som han kategoriserade och gav namn till.

Bild: Mark Tiele Westra
Omkring år 1860 upptäckte Kirchoff och Bunsen att varje kemiskt grundämne har en egen uppsättning spektrallinjer. De drog slutsatsen att Fraunhoferlinjerna skapades genom absorption av vissa våglängder av ljus i solens yttre lager. Några av linjerna skapas också genom absorption av ljus av atomer, som till exempel syre, i jordens atmosfär. Studiet av de här linjerna ledde så småningom till upptäckten av helium i solen, vilket gav det slutgiltiga beviset för att solens kraftkälla är fusion.
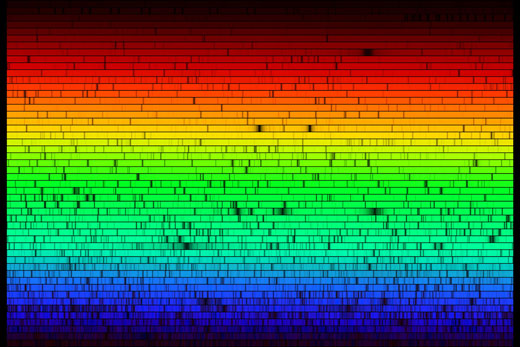
Bild: National Optical Astronomy Observatory/Association of Universities for Research in Astronomy/National Science Foundation
Tack till
Jag står i skuld till Xiaojin Zhu från the University of Wisconsin-Madison, vars hemsida (www.cs.cmu.edu/~zhuxj/astro/html/spectrometer.html) gav mig informationen jag behövde för att konstruera min egen spektrometer och för att tolka resultaten. På hans sida finns det fler spektra. Jag vill också tacka Bartjan van der Meer, som gav mig uppslaget till det här fantastiska vetenskapsprojekt
Resources
- Wikipedia artikel om synliga spektra
Allmän information om spektra
- Wikipedia artikel om elektromagnetiska spektra
- Wikipedia artikel om spektroscopi
- Wikipedia artikel om Fraunhoferlinjer
- Wikipedia artikel om emissionslinjer
Review
Den här artikeln beskriver ett väldigt intressant och hands-on experiment som enkelt kan göras både i en klass och hemma. Spektrometern tillverkas av välkända material och används för att visa ljusets sammansättning och för att jämföra spektra från många olika ljuskällor. Det är speciellt intressant med en historiska bakgrunden till upptäckten av solens spektrum och hur det användes för att identifiera dess sammansättning.
Artikeln kopplar ihop fysik och kemi och borde vara intressant för såväl gymnasie- som universitetsstudenter.
Gaetano Bugeja, Malta





