O Titanic e bactérias que gostam de ferro Understand article
Uma espécie de bactéria descoberta no Titanic está a fornecer novas pistas sobre como proteger células vivas sujeitas a stress.
O RMS (Royal Mail Ship) Titanic está no fundo do oceano, quase 4 km abaixo da superfície da água escura e salgada do Atlântico Norte. Mergulhadores em expedição ao local observaram aglomerados – a que chamaram “rusticles”, porque pareciam ferrugem (rust) e pendiam como pingentes de gelo (icicles) – ricos em ferrugem, que cobriam partes do navio danificado e corroído. Em 2010, os cientistas que investigavam estes aglomerados descobriram aí uma nova espécie de bactériaw1, à qual chamaram Halomonas titanicae.

Wikimedia Commons (domínio público)
O navio naufragado está a enferrujar muito rapidamente: as estimativas sugerem que o navio pode desaparecer completamente até 2030. Pensa-se QUE as Halomonas titanicae poderão estar envolvidas no processo de formação de ferrugem. Se for esse o caso, essas bactérias poderão representar uma ameaça às plataformas de petróleo e a outras estruturas de ferro localizadas no fundo do mar. No entanto, estes organismos tornaram-se alvo de investigação científica por outro motivo: para descobrir como conseguem prosperar em condições de salinidade elevada e variável.
Sais e a célula
O termo halo significa ‘sal’ em grego. Bactérias do género Halomonas vivem em ambientes salgados, como água do mar, ou salinas, onde há grandes flutuações da concentração de sal. Todos os membros do género Halomonas são fortemente halotolerantes: desenvolveram formas de lidar com concentrações extracelulares de sal variáveis, sobrevivendo numa enorme gama de salinidade, de 0,5% a 25% (m/m) de cloreto de sódio. Isso pode parecer uma questão trivial, mas não é.

Imagem cortesia de Lori Johnston, RMS Titanic Expedition 2003, NOAA-OE
As células estão protegidas do mundo exterior por membranas muito finas que controlam o tráfego de entrada e saída da célula, criando e suportando enormes diferenças de composição entre o interior e o exterior. Por exemplo, as células mantêm um potencial eléctrico de cerca de 100 milivolts através da membrana, que normalmente tem apenas 10 nanómetros de espessura. Para todos os tipos de células, o cloreto de sódio (NaCl) é o sal dominante fora da célula (por exemplo, no soro do sangue), enquanto o cloreto de potássio (KCl) é dominante no interior. No entanto, embora os sais sejam diferentes, a concentração total de solutos deve ser exactamente igual dos dois lados da membrana. A razão para isso é a osmose: se duas soluções de concentração diferente são separadas por uma membrana permeável à água, mas não a solutos, a água fluirá do lado mais diluído para o mais concentrado.
As membranas celulares não conseguem lidar com as diferenças de pressão osmótica. Os glóbulos vermelhos rebentam quando colocados em água pura, o que ilustra o efeito da pressão osmótica – e a fragilidade das membranas celulares. Para manter as membranas intactas, as bactérias Halomonas devem ser capazes de regular a concentração de solutos no citoplasma em resposta às flutuações das concentrações externas de sal, sem prejudicar o metabolismo celular (ver Zaccai 2009). Como fazem elas isso?
As bactérias Halomonas produzem grandes quantidades de uma substância chamada ectoína (ver figura 1). Para contrabalançar as concentrações externas de sal, elas sintetizam e ajustam a concentração intracelular daquele composto solúvel. Isso mantém os fluidos celulares em equilíbrio osmótico com o exterior, protegendo a célula de encolhimento ou ruptura, mesmo em condições extremas. Curiosamente, a ectoína parece actuar de maneira diferente da maioria dos sais e solutos, o que pode interferir no papel da água nos processos metabólicos. A ectoína é um ‘soluto compatível’, e por isso preserva o metabolismo normal da célula, e também aumenta a estabilidade de proteínas e membranas. Como consegue este soluto esses resultados?
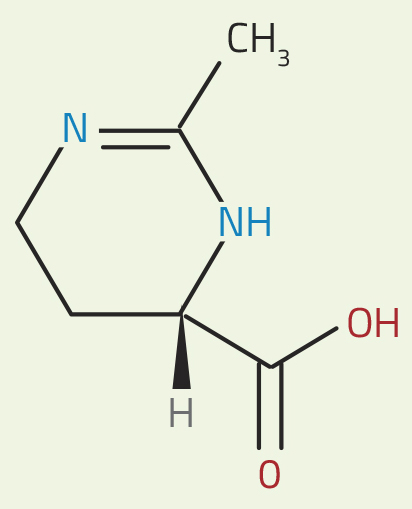
da ectoína. Em água, o grupo
a vermelho fica carregado
negativamente (perde um ião
H+) e o grupo a azul fica com
carga positiva (ganha um ião
H+). Os grupos carregados
formam ligações de
hidrogénio com moléculas de
água adjacentes.
Nicola Graf
Ectoína e a rede de ligações de hidrogénio
A difracção de neutrões, uma técnica experimental avançada (ver a caixa de texto), deu recentemente informação valiosa sobre o modo como a ectoína funciona a nível molecular. Realizadas por uma equipa internacionalw2 que envolve o Instituto Laue-Langevin (ILL)w3, as experiências mostraram como a ectoína influencia a camada de água em redor das moléculas de proteína e nas superfícies das membranas (Zaccai et al., 2016). Normalmente, as moléculas de água interagem umas com as outras através de uma rede de ligações de hidrogénio. Os átomos das moléculas de água interagem com moléculas vizinhas; cada átomo de oxigénio pode aceitar uma ou duas ligações de hidrogénio e cada átomo de hidrogénio pode ser dador de uma ligação. Isso resulta numa rede altamente dinâmica de ligações de hidrogénio intramoleculares, com as moléculas a mudar de parceiros mil milhões (109) de vezes por segundo.
A atracção entre moléculas de água também é a base do ‘efeito hidrofóbico’, que separa o óleo da água. O efeito hidrofóbico é importante em muitos processos biológicos, incluindo o enrolamento tridimensional de moléculas de proteína e a formação de membranas. A dinâmica das ligações de hidrogénio é portanto um factor essencial na organização celular in vivo.
Outras substâncias na água, como sais, podem interferir nessa organização. Mas, como revelaram as experiências de difracção de neutrões, a ectoína parece melhorar a dinâmica das ligações de hidrogénio – pelo menos em parte – em vez de a dificultar. Esta molécula contém um grupo carregado positivamente (a azul na figura 1) e um grupo carregado negativamente (a vermelho). Esses grupos carregados interagem com moléculas de água, tornando a rede próxima de ligações de hidrogénio um pouco menos dinâmica, e, por outro lado, criando uma rede mais dinâmica entre as moléculas de água mais distantes.
Fora do contexto bacteriano, a ectoína está a revelar-se um ingrediente útil em cosmética e em tratamentos clínicos, visto que previne a desidratação da epiderme e reduz a inflamação em células de mamíferos. Segundo se crê, porque, ao estabilizar proteínas e membranas, protege as células humanas de danos, reduzindo assim a inflamação. E isso faz da ectoína um princípio activo adequado para tratamento e/ou alívio de sintomas em patologias como dermatites, rinite e conjuntivite alérgic, ou faringite.
De regresso ao Titanic
Embora as experiências com neutrões tenham ajudado os cientistas a entender como as bactérias Halomonas titanicae prosperam no ambiente hostil em torno do Titanic afundado, está ainda por esclarecer se estas bactérias contribuem para a formação de ferrugem. Mas poderá haver boas notícias: se se verificar que essas bactérias ‘comem’ ferro, elas poderão vir a ter um papel importante na gestão de resíduos, acelerando a decomposição de lixo metálico – e não apenas de navios históricos naufragados – no fundo do oceano.
Difracção de neutrões
A difracção de neutrões é um método poderoso para estudar a estrutura de materiais, incluindo a água e as suas interações com outros compostos.
O núcleo de um átomo de hidrogénio é um único protão. Os neutrões e os protões são partículas muito semelhantes (tirando a carga eléctrica), e os neutrões dispersam fortemente os protões, mais ou menos como as bolas de snooker quando colidem umas com as outras. O padrão de difracção de neutrões fornece informação sobre a localização de átomos de oxigénio e hidrogénio em moléculas de água próximas e, portanto, sobre a rede dinâmica de ligações de hidrogénio que as liga.
A técnica de difracção de neutrões usa outra estratégia muito útil. Os núcleos de átomos de deutério (um isótopo de hidrogénio com um protão e um neutrão no núcleo) difractam os neutrões de maneira muito diferente dos núcleos normais de hidrogénio. Substituir o hidrogénio por deutério num composto específico, ectoína, por exemplo, permite-nos ver a contribuição individual desse composto para o sinal de difracção, que se distingue do das moléculas de água circundantes. Isso, por sua vez, ajuda a revelar os detalhes da interacção composto-água.
A difracção de neutrões com marcação com deutério forneceu resultados muito importantes na área da biologia estrutural, que incluem informação sobre as complexas interacções entre moléculas de proteínas e entre proteínas e ácidos nucleicos (DNA, RNA).

©ILL/L. Thion
References
- Zaccai G (2009) The intracellular environment: not so muddy waters. Science in School 13: 19-23.
- Zaccai G et al. (2016) Neutrons describe ectoine effects on water H-bonding and hydration around a soluble protein and a cell membrane (Neutrons describe ectoine effects on water H-bonding and hydration around a soluble protein and a cell membrane). Scientific Reports 6: 31434. doi:10.1038/srep31434
Web References
- w1 – As bactérias Halomonas titanicae foram descobertas por cientistas da universidade de Sevilha, Espanha, e de Toronto e Halifax, Canadá. Leia no UNESCO website um relatório científico sobre a descoberta.
- w2 – As entidades que colaboraram no estudo incluem o ‘Institut Laue-Langevin’ e o ‘Institut de Biologie Structurale’ em Grenoble, França, e o ‘Max-Planck-Institut für Biochemie’ e a empresa de biotecnologia Bitop, ambos em Munique, Alemanha. Para mais informação, veja a secção de informação complementar on-line em Zaccai et al. (2016).
- w3 – O Instituto Laue-Langevinhe (Institut Laue-Langevin, ILL) é um dos principais centros de investigação em ciência e tecnologia de neutrões, e está situado em Grenoble, França.
Resources
- Consulte este artigo do BBC website para aprender mais sobre micróbios que habitam navios naufragados e sobre o papel da ectoína nas bactérias Halomonas titanicae.
Institutions
Review
Já toda a gente ouviu falar do naufrágio do Titanic, e este artigo pode ser usado para aguçar a curiosidade dos alunos por assuntos científicos. E também pode ser um incentivo para aprofundar o mundo das bactérias – que em geral têm conotação negativa – e mostrar, com vários exemplos, como, afinal, também são muito úteis.
O artigo pode ser útil no ensino de biologia para explicar um dos mecanismos de sobrevivência de procariontes em ambientes extremos, ou a transferência de substâncias através da membrana celular. Também pode ser usado no ensino das ligações de hidrogénio e das interacções entre a água e outras moléculas. Finalmente, a aplicação de Halomonas titanicae em reciclagem é relevante para a ecologia e o estudo do balanço de energia nos ecossistemas.
Alina Giantsiou-Kyriakou, professora de biologia, Escola secundária Livadia, Chipre





