Como é que os músculos produzem trabalho? Usando pinças ópticas no estudo de máquinas moleculares Understand article
Traduzido por Ana Luísa Carvalho. Alexandre Lewalle do King's College, em Londres, no Reino Unido, alarga as fronteiras do nosso conhecimento sobre motores – até ao nível molecular.
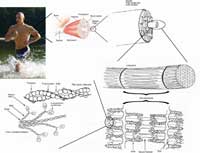
filamentos de actina são os
mais básicos constituintes do
tecido muscular. Formam
filamentos sobrepostos nas
células que deslizam uns
sobre os outros para
contraírem os músculos.
Imagem cortesia de Raul654;
fonte: Wikimedia Commons
Não há muito mistério no que acontece quando levantamos um saco de compras: dobramo-nos, agarramos e puxamos. Sabemos que o nosso corpo transforma energia química em trabalho mecânico, tal como um motor alimentado com combustível. Mas o nosso corpo não é um motor feito de engrenagens e pistões – ou será que é?
De facto, ao nível microscópico, cada célula dos nossos músculos é constituída por milhões de proteínas que se comportam como pequenos motores feitos de um tipo de molécula, não muito maior que alguns nanómetros. Estas proteínas, designadas miosina, estão dispostas de uma forma regular e trabalham em conjunto para produzirem forças e movimento muito superiores ao que conseguem individualmente.
Actualmente, existe um grande entusiasmo em torno da nanotecnologia, a área de investigação que explora e procura controlar o mundo microscópico. No meu laboratório no King’s College, em Londres, usamos um equipamento designado de “pinças moleculares” para manipularmos e estudarmos estes motores individualmente. As máquinas microscópicas fabricadas pelo ser humano podem ainda pertencer ao mundo da ficção científica, mas, através de experiências deste tipo, podemos ir aprendendo as primeiras lições.
Se compreendermos pormenorizadamente como funcionam estas moléculas, saberemos como a natureza, ao longo da evolução, conseguiu produzir, a partir de elementos tão simples, formas de vida tão diferentes. Existem na natureza muitos tipos de “máquinas” constituídas por uma só molécula e as tarefas que desempenham são tão variadas quanto vitais. Permitem que as células vivas funcionem, se movimentem e se reproduzam. Por exemplo, algumas transportam nutrientes através da célula, “passeando” ao longo de uma rede de transporte intracelular. Pensa-se que os motores de tamanho molecular possuam um desempenho crucial na divisão celular ao promoverem a separação dos cromossomas, após a replicação. Outros tipos de motores permitem a rotação dos flagelos que propulsionam os espermatozóides e alguns tipos de bactérias. Estruturalmente, muitos destes motores são semelhantes; no entanto, desempenham tarefas muito distintas.
A contracção muscular resulta do deslizamento de dois tipos de filamentos, um sobre o outro. Um destes filamentos é constituído por miosina (o motor), o outro é constituído por actina (ver figura). Os dois tipos de filamentos encontram-se sobrepostos na célula muscular, por forma a maximizar as interacções entre eles
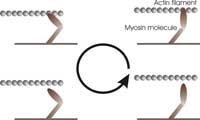
trabalho mecânico puxando
um filamento de actina de
uma forma cíclica: (1) ligação
ao filamento, (2) puxar do
filamento, (3) libertação do
filamento, e
(4) reabastecimento (uma
molécula de ATP).
Imagem cortesia de Alexandre
Lewalle
Tal como qualquer motor, a miosina trabalha de forma cíclica, para assegurar um uso eficiente de energia. A cada ciclo, as moléculas de miosina começam por ligar-se à actina, preenchendo o intervalo entre os dois filamentos. Em seguida, “queimam” combustível reagindo com uma molécula de ATP (o combustível da maioria dos processos biológicos). Esta reacção liberta energia e faz com que as moléculas de miosina movam o seu “braço-alavanca” e puxem o filamento de actina. Em seguida, libertam o filamento de actina regressando à posição original e preparando-se para um novo ciclo.
Durante cada ciclo, os dois filamentos deslizam um sobre o outro por uma pequena distância – é esta a base da contracção muscular. As forças e os movimentos produzidos num só ciclo são muito pequenos, mas a combinação de milhões de moléculas de miosina agindo simultaneamente amplifica este efeito por várias ordens de magnitude.
Os músculos e a miosina têm sido objecto de estudo dos biólogos, há já várias décadas, no entanto, há ainda muito por saber: qual a força exercida por cada molécula individual de miosina e que distância conseguem puxar? Como é que o ambiente químico afecta a duração de um ciclo? Sabemos que o trabalho total realizado pela molécula de miosina é fortemente afectado pela força externa que tem que contrariar, mas a relação entre elas é pouco compreendida. Devido ao seu pequeno tamanho, as moléculas como a miosina reagem ao ambiente que as rodeia de uma forma muito diferente, quando comparamos com moléculas maiores. Por exemplo, ao contrário do que acontece no motor de um automóvel, os efeitos da viscosidade do meio e do bombardeamento contínuo de moléculas de água (o fenómeno conhecido como movimento browniano) são consideráveis. À escala molecular, o movimento através da água é comparável à experiência de tentarmos nadar em mel turbulento!
Os cientistas são insaciavelmente curiosos. Os teóricos elaboram modelos que sugerem como os músculos funcionam, mas apenas o trabalho experimental é que nos pode trazer mais conhecimento. No entanto, um conhecimento detalhado da acção da miosina não pode ser adquirido a partir da observação de um músculo completo, porque o que observamos é apenas o efeito global de muitos motores de miosina actuando de forma independente. O que necessitamos é de uma forma de controlar e examinar as moléculas de miosina isoladas. Mas isto é um desafio monstruoso por si só. Estes não são objectos que possamos pegar e manipular facilmente!
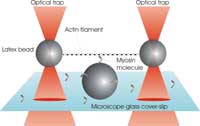
filamento isolado de actina é
esticado entre duas esferas
de plástico presas por pinças
ópticas. A molécula de
miosina pode ligar-se ao
filamento e o seu trabalho é
detectável a partir da
variação das posições das
duas esferas.
Imagem cortesia de Alexandre
Lewalle
Só muito recentemente é que os cientistas conseguiram desenvolver instrumentos que lhes permitem manipular moléculas individuais, abrindo novos caminhos para a investigação e esbatendo as fronteiras tradicionais entre disciplinas como a física e a biologia. As “pinças moleculares”, ou “armadilha molecular”, usam um feixe de laser que, quando focado pela lente poderosa de um microscópio, consegue aprisionar objectos microscópicos. Este efeito de aprisionamento resulta do facto de os fotões possuírem momento e conseguirem exercer forças diminutas nas partículas. O pequeno deslocamento de uma partícula para fora de foco causa uma deflexão do feixe e, de acordo com a terceira Lei de Newton, a partícula sente uma força que a retorna à posição inicial de aprisionamento. Esta técnica muito sensível permite uma manipulação directa das moléculas individuais. O estudo da miosina é possível, uma vez que as forças exercidas pelo laser possuem uma magnitude semelhante às exercidas pela própria miosina.
A nossa experiência em King’s College é desenhada por forma a recrear, sob o microscópio, a unidade básica de um músculo em contracção. O objectivo é investigar como uma molécula de miosina responde a uma força externa aplicada ao filamento de actina, por acção das pinças ópticas. Primeiro, elaboramos duas armadilhas atravessando dois feixes de laser nas objectivas do nosso microscópio (ver figura). Cada armadilha vai aprisionar uma esfera de plástico de 1 micron, revestida por forma a ligar-se a filamentos de actina. Um filamento isolado é preso e esticado entre as esferas, produzindo uma espécie de haltere. Em seguida, guiamos o haltere na direcção de outra esfera presa à superfície da lamela do nosso microscópio, lamela essa, revestida com moléculas de miosina. Com as condições apropriadas, conseguimos que apenas uma molécula de miosina, no topo da esfera, interaja com o filamento de actina do haltere, tal como aconteceria numa fibra muscular.

Imagem cortesia de Alexandre
Lewalle
As interacções entre a miosina e a actina podem ser detectadas pela monitorização das posições das duas esferas do haltere. Quando a miosina se liga e puxa a actina (tal como ilustrado na figura acima), as esferas são deslocadas de uma distância pequena, mas mensurável. Esta distância indica-nos não só o quanto o motor de miosina conseguiu puxar a actina, mas também qual a quantidade de força que foi exercida contra a força de aprisionamento. As nossas medições sugerem que a média de deslocamento de uma molécula de miosina isolada é cerca de 10 nanómetros (a milionésima parte do centímetro), exercendo forças típicas de apenas alguns piconewtons (10-12 newtons). Estes valores são parâmetros importantes para qualquer modelo teórico que procure explicar a fisiologia dos músculos.
Nem é necessário dizer que estas experiências requerem uma boa dose de paciência. Também exigem a colaboração de cientistas com diferentes especializações. Os biólogos são essenciais para relacionarem os resultados experimentais com o conhecimento já adquirido sobre o comportamento fisiológico dos músculos, e para assegurarem que o projecto segue na direcção certa. Os físicos são igualmente importantes ao planearem e garantirem o funcionamento dos componentes ópticos e electrónicos do equipamento e para a análise quantitativa dos resultados. Como em qualquer área de investigação, as fronteiras do nosso conhecimento só se alargam se tentarmos coisas novas e se formos infinitamente curiosos. Da próxima vez que pensares que nada é mais simples que atirar uma bola de basquete, pensa outra vez.
Review
A nanotecnologia é o tema do momento na ficção científica e também na investigação mais avançada e, neste interessante artigo, Alexandre Lewalle descreve-nos os nanomotores das células musculares (os pequenos filamentos de actina e miosina) e como podem ser estudados por intermédio de nanoferramentas (as pinças ópticas).
O artigo, escrito de uma forma agradável com exemplos claros e metáforas vívidas, é adequado aos professores de biologia que queiram actualizar os seus conhecimentos e para estudantes do ensino secundário interessados na investigação mais actual.
Embora o tópico abordado não faça parte dos currículos escolares, encontra-se relacionado com fisiologia e bioquímica, sendo um bom exemplo da investigação actual na área da biomedicina. Pode ser usado para captar o interesse dos jovens na ciência e encorajá-los a prosseguirem os seus estudos nas áreas científicas
Giulia Realdon, Itália





