Waterstofeconomie in de klas Teach article
Vertaald door Piet Das. Zou waterstof het beste alternatief kunnen zijn voor fossiele brandstoffen? Deze demonstratie laat zien hoe een waterstofeconomie in de praktijk zou kunnen werken.
Terwijl fossiele energievoorraden langzaam uitgeput raken, consumeert de groeiende bevolking van onze planeet steeds meer en meer energie. We weten nu dat door het gebruik van traditionele koolstofhoudende brandstoffen de milieuverontreiniging ernstig is toegenomen, waardoor de ontwikkeling van een milieuvriendelijke energieproductie steeds belangrijker wordt .
Een van de meest waarschijnlijke scenario’s voor de productie van de zogenoemde groene energie is de waterstofeconomie. Waterstof heeft een hogere energiedichtheid per gewicht dan traditionele fossiele brandstoffen en het brengt ook minder uitstoot van broeikasgassen. Wanneer waterstof rechtstreeks wordt verbrand of geoxideerd in brandstofcellen om warmte en elektriciteit te verkrijgen, is het enige reactieproduct water.
Hoewel sommige bedrijven nieuwe motoren hebben ontwikkeld op basis van interne verbranding van waterstof, zijn brandstofcellen de belangrijkste energieomzetters waarop het concept van de waterstofeconomie is gebaseerd.
Brandstofcellen werden voor het eerst uitgevonden in de eerste helft van de 19e eeuw , toen de Britse natuurkundige William Grove suggereerde dat als water met behulp van elektriciteit in waterstof en zuurstof kan worden gesplitst, het combineren van de twee elementen elektriciteit zou kunnen opwekken . Doordat fossiele brandstoffen echter dominant werden, vielen brandstofcellen buiten de boot.
In de zestiger jaren gebruikte de NASA alkalische waterstof brandstofcellen in hun Apollo ruimtevoertuigen en later in de space shuttles om zowel elektriciteit als water te produceren . Nu zou de technologie opnieuw een oppepper kunnen krijgen.
De productie en gebruik van brandstofcellen zijn nog vrij beperkt , vooral omdat de productie en opslag van waterstof erg duur zijn, evenals de katalysatoren die bij de meest efficiënte brandstofcellen gebruikt worden. Naarmate echter de technologie verbetert en fossiele brandstoffen duurder worden, zullen brandstofcellen naar verwachting bestaande energiebronnen en omzetters te vervangen.

tussen de elektroden van het
elektrolyse apparaat en het
zonnepaneel
Afbeelding met dank aan Mario
Mitov
Het principe demonstreren
Om te onderzoeken hoe brandstofcellen werken, hebben we een goedkope brandstofcel ontwikkeld voor gebruik in de klas. Het resulterende elektrolyse apparaat en de brandstofcel kunnen worden gebruikt als onderdelen van een installatie om te laten zien hoe waterstof kan worden geproduceerd en gebruikt.
We kozen de volgende criteria voor de modellen:
- De materialen moeten gemakkelijk te verkrijgen zijn en goedkoop
- De hele constructie moet relatief eenvoudig zijn om anderen de mogelijkheid te geven om de verschijnselen en processen te observeren
- De prototypes moeten op een veilige manier gemaakt kunnen worden
Hieronder beschrijven we de Materialen en procedures die nodig zijn om een prototype van een water elektrolyse apparaat en waterstof brandstofcel te maken voor gebruik in de klas.
Practicum

samenstellen van de
brandstofcel
Afbeelding met dank aan Mario
Mitov
Materialen en reagentia
- Plastic spuiten (50 mL)
- Houtskoolstiften of potloodstiften
- Koolstof gas-diffusie electroden gedrukt op Ni-gaasje
- Kleine flexibele slangetjes met kraantjes
- T-stukjes van glas
- Plastic vat (fles) voor het elektrolyt
- Standaard met klemmen
- Aluminium- of koperfolie
- Vetvrij papier
- Warmhoudplaatje
- Glazen vaten (400 mL bekerglazen)
- Geïsoleerde koperdraden met verbindingsstukjes
- Boor
- Siliconenpasta
- 6 – 12 V gelijkstroom voedingsapparaat (zonnepaneel of 9 V batterij)
- eindgebruiker (elektromotor die weinig stroom verbruikt met ventilator, LED)
- paar weerstandjes
- twee multimeters, of een voltmeter en een ampèremeter
- 1 M H2SO4
- 2 M HNO3 (om mee te etsen)
- PdCl2 oplossing, gemaakt door 1 g van het zout op te lossen in 50 ml van 0.5 M HCl. Verwarm tot 50 oC en verdun dan het tot 100 ml met gedestilleerd water.
- 1 M KOH of NaOH
- Handschoenen en veiligheidsbrillen
Werkwijze

van de stoichiometrie van het
uiteenvallen van het water
Afbeelding met dank aan Mario
Mitov
*De stappen gemarkeerd met een sterretje moeten samen met de docent gedaan worden in verband met de veiligheid.
Het maken van het elektrolyse apparaat
- * Verwijder de zuigers en naalden van de twee spuiten.
- * Verwijder de rubberen pakkingen van de zuigers en maak een gat voor een grafietelektrode in elk van de rubber pakkingen.
- Druk de grafietelektroden in deze gaten en doe de rubber pakkingen weer in de spuiten.
- * Boor gaatjes in de zijkant van beide spuiten op ongeveer 1 cm vanaf de bodem. De gaatjes moeten ongeveer 1 mm groter zijn dan de omtrek van je T- stuk.
- Bevestig 1 cm van de lengte van de slang aan beide kanten van het T -stuk.
- Verbind de spuiten met de T-stukjes
- Gebruik het slangetje om het vat met elektrolyt te verbinden met het vrije uiteinde van het T-stukje.
- Maak de dunne flexibele buisjes vast aan de punten van de spuiten.
- * Giet 1M H2SO4 in het elektrolyt vat tot de elektrolyt beide spuiten gevuld heeft.
- Verbind beide elektroden met koperdraden aan het voedingsapparaat (Afbeelding 1).
Het samenstellen van de brandstofcel
- * Verwijder de zuigers en naalden van twee spuiten.
- * Snijd twee stukken van de gasdiffusie-elektroden om de flens van de spuiten volledig te bedekken.
- * Leg een stuk aluminium- of koperfolie op een hete plaat , leg er vetvrij papier op, en plaats dan de gemaakte gas-diffusie- elektrode op het papier.
- * Druk de flens van een injectiespuit op de gasdiffusie- elektrode-vanwege de hoge temperatuur zal de kunststof smelten en de elektrode zal aan de spuit blijven plakken.
- * Boor een gaatje door één kant van de flens en de vastgezette gasdiffusie elektrode.
- Druk een metalen boutje door het gaatje.
- Verwijder de isolatie van het ene eind van een stuk koperdraad, draai het meerdere keren om het boutje en maakt hem vast met een moer.
- Isoleer de bout met siliconenpasta.
- Herhaal de stappen 3 tot 8 om een tweede electrode te maken.
- * Ets de elektroden door ze onder te dompelen in 2M HNO3 gedurende 5 minuten, spoel dan af met water.
- * Giet de PdCl2 oplossing in het 400 mL bekerglas en dompel de voorbereidde elektroden daar 5 minuten in onder. Als de palladiumionen in contact komen met de koolstof en het nikkelgaas wordt door de verdringingsreeks van metalen een dunne katalytische laag van elementair palladium afgezet op de gasdiffusie-elektroden.
- * Giet 100 mL 1M NaOH (of KOH) in een andere bekerglas en zet er beide spuiten met de vastgeplakte elektroden in.
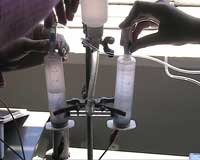
- Verbind deze spuiten met de dunne slangetjes van het elektrolyse apparaat.
Na het verzamelen van een bepaalde hoeveelheid waterstof en zuurstof, stop je de gasproductie en open dan de kleppen om de gassen te laten stromen naar de elektroden van de brandstofcel ( figuur 4 ).
Leerlingen meten de elektrische parameters van de brandstofcel met het in figuur 5 beschreven circuit. De stroomsterkte I wordt berekend volgens de wet van Ohm :
I= V/R

de kraantjes om de gassen te
laten passeren naar de
elektroden van de
brandstofcel; b) het
opwekken van elektriciteit
door de brandstofcel
Afbeelding met dank aan Mario
Mitov
In plaats van een weerstand , kan ook een licht emitterende diode ( LED) of elektromotor die weinig stroom verbruikt worden gebruikt .
Een belangrijk voordeel van dit systeem is dat elke basismodule kan worden vervangen door andere apparaten . Je kunt bijvoorbeeld een speciale windturbine gebruiken in plaats van een zonnepaneel om de elektriciteit te leveren die nodig is om het water te elektrolyseren. Of inplaats van een elektrolyseerapparaat te gebruiken als bron van de gassen waterstof en zuurstof, kun je gas bereiden met een chemische reactie ( figuur 6 ).
Je kunt ook andere versies ontwikkelen van een brandstofcel , die vloeibare brandstoffen (zoals bijvoorbeeld ethanol in plaats van waterstof ) gebruiken.
Zowel het elektrolyse apparaat als de brandstofcel in het voorgestelde ecologische energiesysteem zouden kunnen worden vervangen door onze DeMi Cel die werkt volgens het principe van omkeerbare brandstof cellenw1. Omdat voor DeMi Cellen ongevaarlijke elektrolytzouten gebruikt worden, voldoen ze gemakkelijker aan de veiligheidseisen.
Met een beetje elementaire theoretische achtergrond zijn leerlingen in verschillende educatieve stadia, in staat om prototypes van geavanceerde en verfijnde technologieën ( figuur 7) te ontwikkelen.
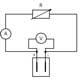
Elektriciteitsschema van het
testen van de brandstofce
Afbeelding met dank aan Mario
Mitov

van een chemische
gasgenerator en gashouder;
Afbeelding met dank aan Mario
Mitov

van de brandstofcel van
waterstof en zuurstof die in
de gashouders verzameld
was
Afbeelding met dank aan Mario
Mitov

een
waterelektrolyseapparaat,
brandstofcellen en
gashouders
Afbeelding met dank aan Mario
Mitov
Een practische demonstratie
Koppeling van het elektrolyse apparaat en de brandstofcellen met een zonnepaneel, zoals getoond in figuur 1, laat zien hoe zonne-energie kan worden opgeslagen als waterstof en daarna weer omgezet in elektriciteit . De elektriciteit die nodig is voor de elektrolyse van water kan worden opgewekt door een kunstmatige lichtbron op het zonnepaneel te laten schijnen, waarna de gevormde gassen boven de elektrolyt in de gescheiden delen van het elektrolyse apparaat (de spuiten) worden verzameld. Kleppen houden de restgassen van de elektrolyse tegen totdat de brandstofcellen het nodig hebben.
De spuiten helpen ook om te laten zien dat het volume van het gas uit de anode tweemaal zoveel is als het volume van het gas uit de kathode: 2 mol waterstof en 1 mol zuurstof uit 2 mol water ( figuur 3 ):
(-) 4 Н2О + 4 е–→ 2 Н2 + 4 ОН–
(+) 4 ОН– → 2 Н2О + О2 + 4 е–
Samengevat 2 Н2О → 2 Н2 + О2
Web References
Resources
- Lex Solar levert pakketten met brandstofcellen en andere vernieuwbare energiebronnen voor scholen. Zie: www.lexsolar.de
- Dit boek geeft een inleiding op het onderwerp brandstofcellen en de waterstofeconomie:
- Cook B (2001) An Introduction to Fuel Cells and Hydrogen Technology. Vancouver, Canada: Heliocentris
- Voor meer informative over Mario Mitov’s werk kun je lezen:
- Mitov M, Kondev I, Petrov Y, Bliznakov S, Popov A (2003) Fuel cells – Achievements and Perspectives. Khimiya 12: 455-466 (only available in Russian)
- Mitov M, Petrov Y, Manev S (2005) Demonstrational Fuel Cells. Khimiya 14: 440-445 (only available in Russian)
- Een ander type brandstofcel is de microbiële brandstofcel , die elektriciteit gebrouwen bier plaats . U kunt lezen over hoe je een van deze te gebruiken in de klas in
- Madden D (2010) The microbial fuel cell: electricity from yeast. Science in School 14: 32-35.
Review
Dit artikel beschrijft een prakticum om het begrip waterstofeconomie uit te leggen, en die kan worden gebruikt om de toepassingen van oxidatie – reductie reacties te introduceren. Hoewel voor het practicum materialen nodig zijn die gewoonlijk niet tot standaard schooluitrusting behoren, is het mogelijk om ze vrij gemakkelijk te krijgen .
Chemie wordt soms gezien als een bijdrage tot vervuiling en schade aan het milieu maar uit deze tekst blijkt dat het ook een belangrijke rol speelt bij de bescherming van het milieu .
Ten slotte kan dit artikel ook worden gebruikt als startpunt om na te denken over de voor- en nadelen van de energiebronnen die momenteel worden gebruikt door onze samenleving en de noodzaak om alternatieven voor fossiele brandstoffen te vinden.
Mireia Güell Serra, Spanje





