Waaruit bestaan sterren? Teach article
Vertaald door Roland Van Kerschaver. Ontdek hoe we weten waaruit de zon (en sterren) bestaan.
In tegenstelling met andere onderdelen van het zonnestelsel, zoals planeten en satellieten, zijn sterren buiten het bereik van ruimtetuigen of, in het geval van de zon, te warm om te benaderen. Hoe kunnen we hen dan verstaan, als we geen gebruik kunnen maken van sondes, rovers of astronauten om hen te bestuderen? Het antwoord is dat we moeten steunen op hun licht. We weten dat de kleur van een ster zijn temperatuur oplevert (Ribeiro, 2015), maar hoe weten we waaruit sterren bestaan? Uit het licht van de ster, of meer specifiek, het spectrum van de ster, is terug het antwoord.
Op het Science on Stage festival dat doorging in Londen in juni 2015, ontspon zich een discussie over het combineren van hands-on experimenten met lesgeven over de chemische samenstelling van een ster, en zo was het idee voor deze activiteit geboren. De activiteit is ontworpen om leerlingen met een ouderdom tussen 15 en 18 jaar toe te laten de verschillende lichtspectra te ontdekken en te verstaan hoe ze gebruikt kunnen worden om chemische elementen te identificeren in lampen, en belangrijker, in onze dichtste ster, de zon.
Lichtspectra
Bij zijn beroemde proef in 1666, gebruikte Isaac Newton een prisma om aan te tonen dat licht kan gesplitst worden in de kleuren waaruit het bestaat en dat deze kleuren konden gerecombineerd worden om wit licht te bekomen. Hij demonstreerde dat de kleuren niet afkomstig konden zijn van het prisma, zoals voordien geloofd werdt, maar dat ze daarentegen componenten waren van golflengtes van zonnelicht. Hij introduceerde het woord “spectrum” om de regenboogkleuren te beschrijven en zijn ontdekking gaf het startschot voor de wetenschap van de spectroscopie.

Voor Newton, bleek het spectrum van de zon continu te zijn, met geen leemtes tussen de kleuren. Maar in 1814, ontdekte Joseph von Fraunhofer dat wanneer het licht voldoende verspreid wordt door een nauwe spleet, het spectrum een aantal donkere lijnen, nu gekend als Fraunhoferlijnen (figuur 1) bevat. Een 45 jaar later, zouden deze lijnen essentieel blijken te zijn bij het bepalen van de samenstelling van de zon, dank zij het werk van Gustav Kirchhoff en Robert Bunsen.
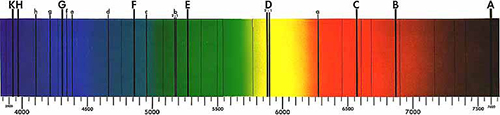
Figuur in het publiek domein; bron: Wikimedia Commons
In 1860, bestudeerden Kirchhoff en Bunsen een verschillende soort van spectrum. In plaats van donkere lijnen te bekijken tegen een heldere achtergrond, bestudeerden ze de heldere lijnen op een donkere achtergrond, uitgezonden wanneer ze elementen verwarmden in de gasvlam van een bunsenbrander. Een van die spectra was die van natrium (figuur 2), die kan bekomen worden bij het verbranden van keukenzout (NaCl) of door een lagedruk natriumlamp zoals die gebruikt voor straatverlichting te laten schijnen.
Bunsen en Kirchhoff besloten dat chemische elementen konden geïdentificeerd worden gebruikmakend van deze emissielijnen en, met dat in het achterhoofd, vonden ze twee nieuwe elementen binnen de twee jaar: cesium en rubidium.
Kirchhoff ging verder met zijn werk en kwam tot het besluit dat de emissielijnen overeenkwamen met verschillende Fraunhoferlijnen. Bijvoorbeeld, de heldere gele lijn van het natriumspectrum bevond zich op dezelfde plaats als een donkere lijn in het gele gedeelte van het zonnespectrum, door Fraunhofer ‘D’ genoemd.

Figuur in het publiek domein; bron: Wikimedia Commons
Deze vroege proeven maakten duidelijk dat er drie hoofdtypes van spectra waren: continu, absorptie en emissie. De eerste toont al de golflengtes, de tweede bevat alléén enkele van de golflengtes van licht, en de derde toont leemtes of donkere lijnen tegen een heldere achtergrond. Deze spectra worden gevormd volgens de drie spectroscopiewetten van Kirchhoff:
- Een continu spectrum wordt uitgezonden door een gloeiende vaste stof, vloeistof of gas onder hoge druk.
- Een absorptiespectrum wordt gevormd wanneer een continu spectrum loopt door een koud gas dat een lage dichtheid heeft.
- Een emissiespectrum wordt uitgezonden door een warm gas onder lage druk.
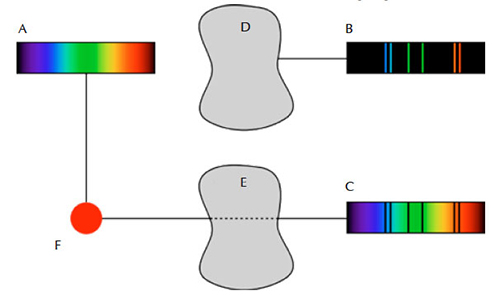
Figuur in het publiek domein; bron: Wikimedia Commons
Kirchhoff had niet enkel gevonden dat een chemisch element verantwoordelijk was voor spectraallijnen op dezelfde plaats in zowel het emissie- als het absorptiespectrum, maar hij had eveneens ontdekt dat de zon natrium bevat. Dus, om de samenstelling van de zon te kennen en van gelijk welke andere ster, moeten we alléén de spectra van gekende elementen vergelijken met de spectra van de ster.
Opnemen van spectra van verschillende lichtbronnen
Materieel
- Verschillende lichtbronnen (zoals gloeilampen, fluorescentielampen, straatverlichting en neonreclamelicht).
- Spectrometers – gebouwd met een granendoosw1 (zie de klasactiviteit) of door het kopen en samenstellen van een opvouwbare mini-spectrometer kit (beschikbaar onlinew2).
- Emissiespectra voor verschillende elementen – bruikbare afbeeldingen kunnen gevonden worden in boeken of gedownload worden van het internetw3.
Bouwen van een spectrometer
Materieel
- Granendoos
- Dik papier
- CD
- Schaar
- Donkere kleefband
Procedure
- Op een van de smalle kanten van de doos wordt in de doos een horizontale spleet uitgesneden. Om een nette lijn te maken zou je gebruik kunnen maken van kleefband om twee kleine stukken dik papier dicht bij elkaar te bevestigen, een kleine spleet makend ertussen. De ideale breedte is 0,2 mm.
- Knip de CD in twee met de schaar. Op de tegenoverliggende kant van waar je juist de spleet aangebracht hebt, knip je een andere horizontale lijn uit. Verleng die lijn verder dan de hoeken van de doos op beide zijden zodat je de CD door de spleet kan glijden, zodat deze gemonteerd is onder een hoek van 60° tenopzichte van de bodem van de doos.
- Snij een gat in het bovenste van de doos, waardoor de CD kan bekeken worden.
- Maak dat er geen strooilicht terecht komt in de doos door de uiteinden van de CD te bedekken met donkere kleefband.
Voor meer informatie over het bouwen van deze spectrometer, klik hier.
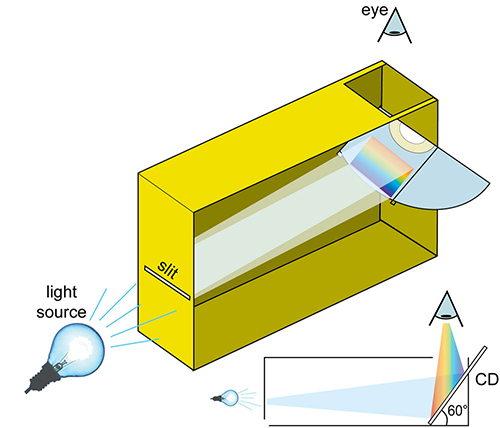
Figuur met dank aan Mark Tiele Westra
Een alternatieve optie is gebruik te maken van de opvouwbare mini-spectrometer, die onlinew2 kan aangekocht worden. Het laat de leerlingen toe de waargenomen spectra te fotograferen met een smartphone.
Waarschuwing in verband met de veiligheid
Kijk niet rechtstreeks naar de zon, zelfs niet met een spectrometer. In plaats daarvan, richt je spectrometer naar de hemel om het spectrum van verspreid zonnelicht te bekijken.
Procedure
Vergelijken van spectra
Vraag de leerlingen om het licht van de verschillende lichtbronnen te bekijken door een spectrometer. Dit zal hen tonen dat niet al de lichtbronnen dezelfde zijn, omdat hun spectra niet dezelfde zijn.
Vragen:
- Welk type van spectrum wordt uitgezonden door elke lichtbron?
- Wat zegt dat over het type van de lichtbron,
- Welke lichtbron wordt het meest gebruikt en waarom?
Verklaring:
De leerlingen zullen een verschillend spectrum waarnemen afhankelijk van de lichtbron:
- Een gloeilamp zendt een continu spectrum uit waarin alle zichtbare kleuren aanwezig zijn.
- Een gasontladingslamp bevat typisch helium (He), neon (Ne), argon (Ar), krypton (Kr) en xenon (Xe) (figuur 3). Elk gas zendt zijn eigen emissiespectrum uit.
- Straatverlichting bevat gewoonlijk natrium en zal daarom het emissiespectrum van natrium uitzenden.
- Het spectrum uitgezonden door een LEDlamp hangt af van het halfgeleidermateriaal van de LED. Een blauwe LED brengt een continu spectrum voor met een helderder blauw deel van het spectrum.
- De zon zendt een continu spectrum uit. Een meer gesofistikeerde spectrometer zal de donkere absorptielijnen bepaald door de elementen waardoor het licht loopt in de atmosfeer van de zon tonen.
De verschillende spectra wijzen er op dat deze lichtbronnen, en het mechanisme achter hun vorming, verschillend zijn, uitgenomen voor de zon en de gloeilamp. De lichtbron die meest gebruikt wordt is de gloeilamp omdat het een continu spectrum heeft als de zon.
Analyseren van emissiespectra
Gebruikmakend van verschillende gasontladingslampen, wordt aan de leerlingen gevraagd de elementen te bepalen die aanwezig zijn door het spectrum van de lamp te vergelijken met de afgedrukte afbeeldingen van verschillende emissiespectra van elementen. Dit is de basis van de spectroscopie als een methode voor chemische analyse.
Waarschuwing in verband met de veiligheid
Omdat gasontladingslampen een hoge spanning vereisen, moeten ze door de leraar gehanteerd worden.

Figuur met dank aan Heinrich Pniok; bron: Wikimedia Commons
Vragen:

mini-spectrometer gebruiken
voor het bepalen van het
emissiespectrum van helium
Figuur met dank aan Ole
Ahlgren
- Hebben alle spectraallijnen dezelfde intensiteit?
- Wat is het verband tussen de spectraallijnen en de kleur van de lamp?
- Hoe kunnen de spectra gebruikt worden om de verschillende elementen te identificeren?
Uitleg:
Sommige golflengtes zijn meer intens dan andere, dat maakt dat dat sommige emissielijnen helderder zijn dan andere. Dit wordt getoond in de kleur van de lamp. Bijvoorbeeld, het licht van een natriumlamp is geel van kleur omdat het voornamelijk geel licht uitzendt, niettegenstaande het ook rood en groen licht uitzendt. Omdat elk element zijn eigen specifieke golflengte heeft, kan je spectra gebruiken om te bepalen welke chemische elementen aanwezig zijn.
Uitbreiding van de activiteit
Om meer gedetailleerde resultaten te bekomen, kunnen aanvullende activiteiten uitgevoerd worden met een spectrometer waarmee het mogelijk is de absorptielijnen van de zon te detecteren, en door gebruik te maken van de software van een gepaste datalogger. Figuren 4 en 5 werden opgenomen met de Ocean Optics Red Tide spectrometer en het programma LoggerPro.
De bekomen spectra zijn verschillend van die opgenomen met een eenvoudige spectrometer en bevatten meer informatie, met inbegrip van de golflengte van elke spectraallijn en zijn relatieve intensiteit. Het spectrum van de zon kan eveneens tonen dat de aanwezigheid van absorptielijnen niet betekent dat bepaalde golflengtes van licht volledig ontbreken maar alléén dat ze minder intens zijn dan de andere golflengtes.
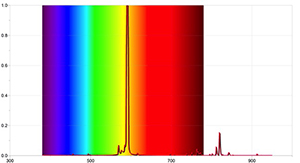
Figuur met dank aan Ole Ahlgren
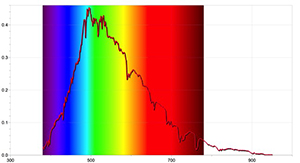
Figuur met dank aan Ole Ahlgren

van kwik met de Ocean
Optics Red Tide spectrometer
en het programma
LoggerPro.
Figuur met dank aan Ole
Ahlgren
Materieel
Procedure
De leerlingen kunnen het spectrum van de zon opnemen gebruikmakend van de meer gesofistikeerde spectrometer. Het datalogger programma zal de golflengte geven van de absorptielijnen die de leerlingen kiezen. De gekozen absorptielijn moet de meest prominente zijn. Om de aanwezige elementen te bepalen, zijn er twee mogelijkheden:
- De leerlingen vergelijken iedere golflengte met deze van een tabel, zoals deze beschikbaar op de website van het Columbus Optical SETI Observatoriumw6.
- De leerlingen loggen de emissiespectra van verschillende elementen en vergelijken daarna de golflengten van die lijnen met deze van de zon. Het aantal elementen dat gebruikt kan worden is beperkt tot deze aanwezig in de gasontladingslampen. Het is mogelijk metalen te verbranden en emissiespectra te krijgen, maar er zullen lijnen van andere elementen aangetroffen worden. Bijvoorbeeld zijn de meest prominente lijnen getoond in figuur 6 bekomen bij het verbranden van magnesium te wijten aan de aanwezigheid van stikstof.

Figuur met dank aan Ole Ahlgren
Bij het opnemen van spectra van verschillende lichtbronnen en chemische elementen en bij het vergelijken met het spectrum van de zon, kunnen de leerlingen de samenstelling bepalen van de zon en andere sterren.
References
- Ribeiro C (2015) Starlight inside a light bulb. Science in School 31: 37–42.
Web References
- w1 – Voor instructies voor het bouwen van je eigen spectrometer met een granendoos, bekijk: Westra M (2007) A fresh look at light: build your own spectrometer. Science in School 4: 30-34.
- w2 – Je kan een opvouwbare mini-spectrometer kit online bestellen in de Public Laboratory store.
- w3 – Emissiespectra voor verschillende elementen kunnen gedownload worden in de Open Discovery Space.
- w4 – Voorbeelden van bruikbare spectrometers te gebruiken bij de uitbreiding van deze activiteit kunnen hier gevonden worden.
- w5 – LoggerPro is een programma voor Windows en Mac computers dat gegevens verzamelt en analyseert en dat prijzen gewonnen heeft.
- w6 – Fraunhoferlijnen en hun golflengtes kunnen bekeken worden op de website van he Columbus Optical SETI Observatorium.
Resources
- Voor een overzicht van het praktisch gebruik van licht, bekijk:
- Douglas P, Garley M (2010) Chemistry and light. Science in School 14: 63-68.
- Science on Stage is het europees netwerk voor leraars wetenschappen, technologie, enginering en matimatica (STEM), welke oorsponkelijk opgestart is in 1999 door het EIROforum, de uitgever van Science in School. Science on Stage brengt wetenschapsleraars van heel Europa bij elkaar om leerideëen en voorbeelden van goede praktijk met enthoesiaste collega’s uit 25 landen uit te wisselen.
Institutions
Science on StageReview
In dit artikel beschrijven de auteurs in het kort hoe spectra ontdekt werden en hoe verschillende soorten spectra gebruikt kunnen worden om te bepalen waaruit sterren bestaan.
Ze tonen ook hoe zelfgemaakte spectrometers kunnen gebouwd worden en gebruikt bij spectrale metingen. Deze leeractiviteit kan fascinerende resultaten opleveren bij het gebruik van deze spectrometers.
Denkvragen over dit onderwerp kunnen zijn:
- Hoe heeft Newton het spectrum van licht ontdekt?
- Welke kleuren treffen we aan in het spectrum van licht?
- Met welke kleuren start en stopt het spectrum van zichtbaar licht?
- Beschrijf de ontdekkingen van Bunsen en Kirchhoff.
Gerd Vogt, Hogere Secundaire School voor Milieu en Economie (HLUW), Yspertal, Oostenrijk





