Plastica, naturalmente Understand article
Traduzione Davide Del Campo. Ci sediamo sopra, con esse ci vestiamo, ce ne serviamo per cucinare: le materie plastiche sono dappertutto. Ma questa grande versatilità ed abbondanza rende la plastica ancora più difficile da produrre e da smaltire in modi ecologicamente compatibili. David Bradley…

Immagine fornita cortesemente
dall’ Università di Manchester
Il giocattolino di plastica nella scatola di cereali del mattino è un cliché largamente usato al momento della prima colazione. Tuttavia, lo smaltimento di milioni di tonnellate di rifiuti di plastica ogni anno è un problema crescente che richiede una discussione più seria che non qualche chiacchiera sui cornflakes. Il lavoro condotto da Colin Webb e dai suoi colleghi Ruohang Wang and Apostolis Koutinas, nel Satake Centre for Grain Process Engineering all’Università di Manchester, ci fornisce una fantastica soluzione per la plastica che non solo promette di risolvere il problema dello smaltimento, ma apre inoltre un nuovo futuro sostenibile per la produzione.
Con il supporto dell’Engineering and Physical Sciences Research Council (EPSRC)w1, i ricercatori stanno combinando la tecnologia della produzione e la biotecnologia con la chimica dei cereali per sviluppare un sistema originale e altamente efficiente per trasformare chicchi di cereali in materie bioplastiche biodegradabili. Stanno anche approfondendo delle tecniche di trasformazione per rimuovere la crusca dal chicco – chiamate “pearling” – che funzioneranno come un metodo generale per estrarre composti utili da una vasta gamma di cereali rendendoli adatti ad essere usati come precursori di nuovi materiali.

come “pearling” del chicco i
ricercatori mirano a togliere
lo strato più esterno ai semi
per macinarli in farina –
producendo un materiale di
partenza ricco di nutrienti ed
enzimi che può alimentare
microrganismi adatti alla
produzione di bioplastiche
Immagine fornita cortesemente
dall ’Università di Manchester
Questi potrebbero includere zuccheri a catena corta per altre fermentazioni, arabinoxilani per applicazioni mediche, l’antiossidante acido ferulico (un precursore di composti aromatici come la vanillina), così come prodotti alimentari funzionali.
Evitare le discariche
Le materie plastiche hanno rivoluzionato la vita moderna, fornendoci ogni cosa dalle calze di nylon ai massaggiagengive ai condom di gomma sintetica ipoallergenici. La plastica è comunque un prodotto petrolchimico e con la produzione annuale di mezzo miliardo di tonnellate annuali dipendiamo dagli idrocarburi fossili per la sua produzione. Inoltre, il carattere usa e getta di molti materiali plastici, fa sì che ci siano seri problemi ambientali in quanto i prodotti petrolchimici non si degradano naturalmente. Scarti di plastica possono essere destinati all’ incenerimento, ma questo produce inquinamento.
La plastica può essere riciclata, ma anche questa modalità presenta i suoi problemi di lavaggio, di separazione, e di ricerca di applicazioni per i materiali ottenuti. Sfortunatamente il sotterramento in discarica è ancora oggi il metodo più sano e meno costoso per lo smaltimento. Ma con il 40% dei prodotti di plastica sepolti in discarica queste si stanno riempiendo velocemente.” Le questioni ambientali, la crescente domanda di energia, le preoccupazioni politiche e l’esaurimento a medio-termine del petrolio hanno fatto nascere la necessità di sviluppare tecnologie sostenibili basate su materiali grezzi rinnovabili,” dice Colin. Insieme ai suoi colleghi, spera di affrontare questo problema grazie allo sviluppo di materiali alternativi per l’industria della plastica basati sulla coltivazione di cereali, piuttosto che sulle nostre scorte limitate di olio grezzo. “ La scelta di materia prima adatta a rifornire processi sostenibili dipende da fattori infrastrutturali, economici e tecnologici come la reperibilità, il personale qualificato, la tecnologia dei pre-trattamenti e i costi e il trasporto” afferma Apostolis. “I cereali appartengono a quelle poche materie prime che soddisfano al momento alla maggior parte di questi prerequisiti” I cereali sono abbastanza nutrienti da poter sostentare una schiera di microrganismi, come Aspergillus awamori, e questo può essere sfruttato per sviluppare un metodo generico per trasformare i chicchi usando la fermentazione microbiologica in materiali che possono essere convertiti chimicamente o attraverso un’ulteriore fermentazione in biocombustibili, prodotti chimici e bioplastiche (plastiche derivate da fonti vegetali, piuttosto che dal petrolio).

Manchester credono che, con
l’uso di microbi produttori di
plastica, coltivazioni di grano
possano sostituire
idrocarburi fossili come fonte
di molte materie plastiche
Immagine fornita cortesemente
da David Bradley
L’idea ha molti vantaggi, non ultimo dei quali quello che le colture di cereali sono risorse rinnovabili e il loro utilizzo è essenzialmente neutrale rispetto al carbonio. Inoltre, i prodotti della chimica dei cereali, comprese le bioplastiche, saranno biodegradabili, decomponendosi alla fine nel suolo in nient’altro che acqua e diossido di carbonio: un contrasto netto rispetto ai 10.000 anni di vita di polietilene e PVC. Ci sono anche molti vantaggi socioeconomici nel trasformare cereali in materia prima per l’industria, inclusa una ridotta dipendenza dalle scorte di olio grezzo in graduale diminuzione e i benefici derivanti agli agricoltori dallo sviluppo della coltivazione dei cereali.
Al momento, ci sono tre modi per produrre bioplastiche. Il primo implica la produzione attraverso la fermentazione di materia prima derivata da cereali o altre colture. Questa tecnica richiede fasi di estrazione e di purificazione. Il secondo metodo prevede di progettare modi per “coltivare” la plastica dentro la stessa pianta, e quindi sono richieste fasi di raccolto e di purificazione. Infine, i cereali potrebbero essere usati per produrre, ancora attraverso la fermentazione, diversi precursori, che potrebbero poi essere convertiti in bioplastiche. Se microrganismi naturali non possono produrre le desiderate bioplastiche, allora anche essi potrebbero essere geneticamente manipolati per questo scopo.
Microbi intelligenti
I microbi che producono la plastica usano zuccheri semplici, come il glucosio, come fonte di carbonio e composti organici azotati, come aminoacidi e peptidi a catena corta, come fonte di azoto. Tutti questi nutrienti sono presenti nei chicchi dei cereali. Inoltre, i chicchi contengono anche le vitamine e i sali minerali essenziali per la crescita microbica. Alcuni chicchi hanno un gran potenziale per la produzione di fonti di composti chimici funzionali. Il grano, per esempio, vince su tutti perché contiene utili agglutinina e lipidi, arabinoxilani, acido fitico e vitamine, e zuccheri a catena corta. Il “perling” del chicco nel togliere lo strato più esterno ai semi per macinarli in farina produce un materiale di partenza ricco di nutrienti ed enzimi che può alimentare microrganismi adatti alla produzione di bioplastiche. “ Questa strategia di bioraffinazione fornisce una materia prima adatta alla susseguente fermentazione microbiologica per la produzione di bioplastiche ed altri prodotti chimici,” dice Colin.
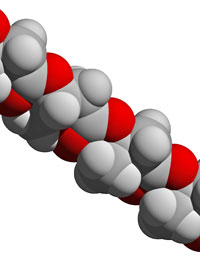
biodegradabili come il PHB
(polidrossibutirato – la cui
struttura è qui mostrata)
sono costosi da produrre e
non adatti a molte
applicazioni. I ricercatori
dell’EPSRC sperano di trovare
una via economica per
ottenere plastiche “verdi”
Immagine fornita cortesemente
da David Bradley
“Le bioplastiche microbiologiche troveranno molte applicazioni come materiali usa e getta, come le confezioni per alimenti, che non possono essere riciclate.”
Professor Colin Webb
Non sarà possibile sviluppare processi per produrre bioplastiche per tutte le applicazioni, ma i ricercatori sperano di poter coprire molti usi. “Le bioplastiche microbiologiche troveranno molte applicazioni come materiali usa e getta, come le confezioni per alimenti , che non possono essere riciclate. È anche possibile miscelare bioplastiche ad altri materiali per ottenere bioplastiche resistenti alla biodegradazione. Alternativamente, il riciclaggio potrebbe essere sviluppato come un metodo generico per la produzione di oggetti più duraturi,” aggiunge Colin. Il processo convenzionale sui chicchi per la produzione di sciroppi di grano e altri alimenti e prodotti per l’alimentazione animale produce una quantità enorme di rifiuti e di acque di scarico, ha un alto costo, e non utilizza tutti i preziosi prodotti chimici di queste fonti naturali, inclusi inapprezzabili nutrienti ed enzimi. Nel loro nuovo processo il team di Manchester ha provato a sfruttare completamente il potenziale dell’ intero chicco di cereale per sviluppare bio-raffinazioni fattibili alla produzione di bioplastiche o di altri prodotti di valore aggiunto. Il loro lavoro ricerca applicazioni per i nuovi mercati.
“Il glutine per esempio, potrebbe essere usato come bioplastica in molte applicazioni.” Dice Apostolis, “mentre gli arabinoxilani potrebbero essere usati in applicazioni mediche, così che nessun sottoprodotto dei cereali andrebbe sprecato.” Colin aggiunge: “ L’attuale industria delle materie plastiche sarà gradualmente trasformata da processi che utilizzano prodotti petrolchimici in altri basati sulle materie prime dalle biomasse rinnovabili. L’imminente esaurimento delle risorse petrolifere forzerà questo cambiamento,” dice, “facendo dei cereali i più probabili candidati come materiali grezzi per la produzione delle bioplastiche.”. Secondo Colin, il successo di questa impresa dipenderà dalla collaborazione con le industrie o altri patner accademici che possano fornire esperti su bisogni dei mercati, sulle tecnologie di produzione industriale, sulla chimica, sulla coltivazione di cereali e sull’analisi dei cicli di vita. Colin commenta: “ Lo scopo per cui si è finora lavorato a questo progetto è stato quello di puntare al miglioramento degli aspetti economici della produzione delle materie plastiche attraverso la fermentazione, che è uno dei principali ostacoli a questo processo.” Se si avrà successo, allora i giocattolini di plastica nella scatola dei vostri cereali un giorno saranno ecosostenibili come i cereali stessi.
Web References
- w1 –EPSRC finanzia la ricerca e la formazione post-laurea in ingegneria e in fisica nell’Università e in altre organizzazioni in tutto il Regno Unito.
Review
La produzione della plastica non è di norma inserita nelle lezioni di scienze, ma quest’articolo esamina uno di quegli aspetti di scienza-accessoria che sono rilevanti nei problemi dello sviluppo delle società umane.
Ai nostri giorni, la sostenibilità delle risorse naturali e il riscaldamento globale causato dall’uomo sono i principali fattori limitanti per ogni modello di sviluppo sociale. Mentre alcuni gruppi sostengono la convenienza dell’energia nucleare o lo sviluppo di sorgenti alternative di energia, Bradley dimostra che progredire nella gestione efficiente di risorse rinnovabili può avere effetti positivi.
L’articolo tratta di efficienza, sostenibilità, riduzione del nostro personale carbon footprint, risorse naturali e struttura sociale. Inoltre esso mostra come la specializzazione scientifica (così spesso criticata) rende possibile progressi in aree molto piccole di conoscenza che possono essere utilizzate in un senso molto ampio.
All’interno della aula scolastica, l’articolo offre applicazioni interdisciplinari. Gli insegnati di scienze ambientali e di educazione ambientale della scuola media o delle prime classi delle superiori possono usarlo per illustrare e trattare alcuni concetti basilari come la sostenibilità, il ciclo del Carbonio e l’influenza umana, i cambiamenti nella struttura sociale o l’importanza dell’agricoltura e della conservazione del suolo.
Ecco qualche possibile attività in relazione all’articolo:
- Gli studenti possono elaborare un semplice indice sulla sostenibilità per differenti risorse (plastiche convenzionali, bioplastiche, suolo agricolo, fertilizzanti azotati, legno e silvicoltura, petrolio, biocombustibili, e così via) e usarlo per discuterne le conseguenze ambientali.
S = NGa x (1 +RCr +RUr)
HUa + DaWhere: NGa =massa di origine naturale (massa/tempo)
RCr =rapporto di riciclo (adimensionale, 0 to 1)
RUr =Re-rapporto d’uso (adimensionale, 0 to 1)
HUa =massa usata dall’uomo (massa/tempo)
Da =massa degradata (massa/tempo)
- Gli studenti possono elaborare un semplice modello di ciclo del Carbonio introducendovi gli effetti delle bioplastiche o dei biocombustibili.
- L’articolo accenna all’influenza delle bioplastiche sulla connessione tra le strutture agricole e industriali. Gli insegnanti possono mettere in relazione i concetti di bodiversità e diversità sociale con la loro influenza sulla stabilità e sulla sopravvivenza degli ecosistemi e delle società.
- Le bioplastiche (e i biocombustibili) hanno bisogno di agricoltura e di suolo. Gli insegnanti possono illustrare l’importanza della conservazione del suolo, dell’erosione e della contaminazione.
- Gli studenti possono valutare il rapporto tra l’ammontare dei rifiuti di plastica nella loro aula e il carbon footprint del gruppo. Quindi essi possono stimare gli effetti del cambiamento del loro carbon footprint passando dalle plastiche convenzionali alle bioplastiche.
- Gli insegnanti possono guidare gli studenti nel tracciare diagrammi di flusso paralleli per i processi che sono coinvolti nella produzione e nello smaltimento di diversi prodotti: bioplastiche e plastiche dal petrolio, bottiglie, tavole di legno o di metallo, gasoli per diesel o biocombustibili.
- Gli insegnanti possono anche usare diverse domande indirette per arrivare a definire come le bioplastiche possano influenzare le nostre vite. Le seguenti sono degli esempi: Come possono le biolpastiche salvare i ghiacciai antartici? Come possono le bioplastiche aiutare nell’evitare cambiamenti nel livello dei mari? Come possono le bioplastiche salvare gli uccelli che vivono nelle discariche della vostra città?
Juan de Dios Centeno Carrillo, Spagna





