GFP: la vita dipinta di verde Understand article
Traduzione di Federico Maria Rossi. Da una medusa a sensori per l’arsenico attraverso un premio Nobel: Sonia Furtado parla della scoperta e dello sviluppo della proteina fluorescente verde e chiacchiera con i ricercatori del Laboratorio Europeo di Biologia Molecolare (EMBL) presso Heidelberg,…
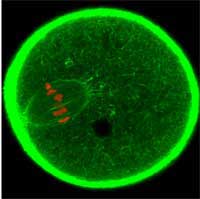
dividendo per diventare un
ovulo. Si è usata la GFP per
marcare il citoscheletro
actinico della cellula in verde
e i cromosomi in rosso
Immagine cortesemente messa
a disposizione da Jan Ellenberg
/ EMBL
Tutto iniziò con una medusa: la trasparente Aequorea Victoria presenta delle macchie intorno al suo bordo che si illuminano di verde quando viene agitata, comportamento che venne descritto per la prima volta nel 1955. Lo studio di questa “stranezza” ha portato a quella che viene ritenuta una rivoluzione scientifica e, recentemente, al premio Nobelw1 per tre ricercatori. Tutto a causa di una sola proteina, chiamata proteina fluorescente verde (o GFP, dall’inglese “Green Fluorescent Protein”), che è responsabile della fluorescenza della medusa.
Agli inizi degli anni Sessanta, il ricercatore giapponese Osamu Shimomura scoprì l’equorina, una proteina della medusa che si illumina alla presenza di calcio. Tuttavia, l’equorina si illumina di blu, mentre la medusa brilla di verde, perciò qualcosa deve trasformare la luce blu dell’equorina in quella verde della medusa. Shimomura scoprì che questo qualcosa è un’altra proteina: la GFP, che assorbe la luce blu e ultravioletta dell’equorina ed emette luce verde, conferendo alla medusa il suo bagliore.
Poi al biologo statunitense Martin Chalfie venne in mente come usare questo effetto: pensò che alcuni organismi comunemente usati in laboratorio potessero essere geneticamente modificati attaccando il gene della GFP a uno specifico gene di interesse per i ricercatori. Così, una volta espresso (cioè tradotto in proteina), il gene di interesse sarebbe stato attaccato alla GFP. Tale procedura avrebbe permesso ai ricercatori di sapere quando e dove un gene è espresso: sarebbe loro bastato illuminare l’organismo con luce ultravioletta e cercare il bagliore verde.
A quei tempi, tuttavia, mancavano ancora due elementi prima che l’idea di Chalfie potesse essere applicata: bisognava identificare il gene della GFP e si doveva capire il meccanismo alla base della fluorescenza della GFP. I ricercatori sapevano che la GFP brilla perché tre dei suoi amminoacidi formano un fluoroforo, un gruppo chimico che assorbe ed emette luce. Ritenevano anche che la GFP necessitasse di altre proteine, chiamate enzimi, per poter essere ripiegata nella sua forma corretta – come accade per la maggior parte delle molecole naturalmente fluorescenti allora conosciute –, e pensavano che solo la A. victoria fosse in grado di produrle.
Così, quando il biochimico Douglas Prasher identificò il gene della GFP nel 1992, il pensiero comune era che l’introduzione del gene in altri organismi avrebbe portato alla produzione di una versione non funzionante della GFP. Tuttavia, quando Chalfie e il suo gruppo inserirono il gene della GFP appena scoperto nel DNA di un batterio, questo si illuminò di verde!
Immagine cortesemente messa a disposizione dalla Typoform / the Royal Swedish Academy of Sciences (RSAS)

della GFP si piega a formare
un cilindro, con il fluoroforo
al centro
Immagine cortesemente messa
a disposizione dalla Typoform
/ the Royal Swedish Academy
of Sciences (RSAS)
È così che si è capito che la GFP non ha bisogno di enzimi per illuminarsi. Essa, infatti, si ripiega spontaneamente nella forma corretta e, come scoprì il biochimico Roger Tsien, la reazione tra gli amminoacidi nel fluoroforo richiede solo ossigeno, che è prontamente disponibile nella maggior parte delle cellule viventi.
Avendo stabilito il modo esatto in cui si forma il fluoroforo della GFP, Tsien fu in grado di manipolare questa proteina. Modificando diversi amminoacidi in diverse parti della catena, sviluppò nuove versioni della GFP che fossero più brillanti, che assorbissero luce a diverse lunghezze d’onda e che si illuminassero di diversi colori: ciano, blu e giallo. E, quando venne scoperta una proteina fluorescente rossa in un corallo, Tsien e i suoi collaboratori usarono le conoscenze derivate dalla GFP per trasformare anche quella proteina fluorescente rossa in un marcatore biologico.
Shimomura, Chalfie e Tsien sono stati insigniti del premio Nobel per la chimica nel 2008 “per la scoperta e lo sviluppo della proteina fluorescente verde” e ricercatori di tutto il mondo hanno continuato a sviluppare varianti della GFP, che sono ora disponibili praticamente in tutti i colori dell’arcobaleno.
Al momento, la GFP è diventata uno strumento prezioso per i ricercatori di tutto il mondo. Danneggia le cellule molto meno di marcatori fluorescenti di natura chimica. Dopo essere stato illuminato per un certo periodo di tempo, un fluoroforo rilascia un elettrone e poi non si illumina più: si è “sbiancato” (in inglese “bleached”, da “bleach”, cioè candeggina).
Gli elettroni rilasciati in questo processo reagiscono rapidamente con l’ossigeno, formando radicali liberi molto tossici, che danneggiano i componenti cellulari, causando alla fine la morte della cellula. Ma la struttura della GFP funziona da scudo, proteggendo la cellula. Quando un fluoroforo rilascia un elettrone, i radicali che si formano reagiscono con la GFP, così danneggiano la GFP, ma non la cellula.
E benché gli scienziati usino la GFP come marcatore attaccandola a specifiche proteine, diversi ricercatori la usano per studiare diversi processi che hanno luogo a dimensioni completamente differenti, marcando qualsiasi cosa, da gruppi di cellule a singole molecole
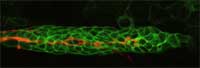
in arancio, guida altre cellule
(verdi) mentre migrano lungo
un embrione di zebrafish
durante lo sviluppo
Immagine cortesemente messa
a disposizione da Darren
Gilmour / EMBL
“Questo è il bello della GFP”, dice Darren Gilmour, un ricercatore presso l’EMBLw2: “con essa, si possono studiare le grandezze più diverse – le si possono colorare con la stessa pittura, non serve cambiare pennello”.
Nel loro lavoro sugli embrioni di zebrafish, Darren e il suo gruppo usano la GFP per marcare gruppi di cellule, che possono poi seguire durante lo sviluppo dell’embrione, studiando come si comportano, dove vanno e che tessuti ed organi vanno infine a formare. Gli embrioni di zebrafish che Darren studia sono trasparenti, per cui si potrebbe pensare che sia facile vedere cosa succede al loro interno. Il problema, dice Darren, è che succedono troppe cose. “È un caos. Non ci si può concentrare su niente, non si riesce a distinguere nulla. Ma con la GFP”, aggiunge, “si possono spegnere le luci e concentrarsi solo su un gruppo di cellule o addirittura su una singola cellula”. (Per un approfondimento sul lavoro di Darren, si veda Spinney, 2007).
La possibilità di seguire processi dinamici è cruciale anche per Francesca Peri, poiché le permette di seguire al microscopio lo sviluppo dei suoi embrioni di zebrafish per diversi giorni. L’unica alternativa sarebbe sacrificare l’animale, sezionarlo e fotografarlo. “Sarebbe come cercare di capire una partita di calcio basandosi solo su una dozzina di fotografie”, dice Francesca. “Non si riuscirebbe ad avere il quadro nel suo complesso”. Francesca e il suo gruppo studiano la microglia, cellule che sono capaci di fagocitare i neuroni morenti o danneggiati. “Usando la GFP, possiamo differenziare i vari tipi cellulari attraverso un codice-colore: per esempio, la microglia potrebbe essere marcata in verde, mentre i neuroni in rosso. Così, se vediamo una cellula rossa dentro una cellula verde, sappiamo che un neurone è stato fagocitato per impedirgli di danneggiare il resto del tessuto cerebrale”.
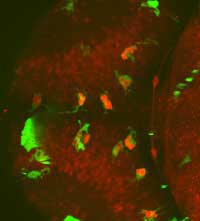
possono osservare nel suo
complesso il cervello di uno
zebrafish vivo in via di
sviluppo, studiando i rapporti
tra la microglia (in verde) e i
neuroni (in rosso), fino a
scoprire alcuni neuroni
all’interno della microglia
(rosso brillante)
Immagine cortesemente messa
a disposizione dal Francesca
Peri / EMBL
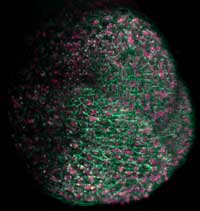
sono state usate per marcare
in verde le membrane
cellulari e in rosa i nuclei in
questa immagine
tridimensionale del
meristema apicale di una
pianta di Arabidopsis,
germoglio che darà origine
alla parte aerea della pianta
Immagine cortesemente messa
a disposizione da Ernst Stelzer
/ Marcus Heisler / EMBL
Marcus Heisler e il suo gruppo usano la GFP e le sue varianti per studiare le piante. Si concentrano su un ormone vegetale chiamato auxina, che è portato all’esterno della cellula da un trasportatore che si trova sulla membrana cellulare. Questo trasportatore si può muovere da una parte all’altra della cellula, cambiando la direzione in cui l’ormone è secreto. “La GFP ci permette di seguire questo processo così dinamico in piante vive”, dice Marcus, “e ci fornisce una buona risoluzione tridimensionale”.
L’affidabilità della GFP è cruciale per ottenere immagini tridimensionali, dice Ernst Stelzer, il cui gruppo si concentra sullo sviluppo di tecnologie per la microscopia in 3D protratta nel tempo. “Riuscire a far penetrare un colorante in un campione di un certo spessore è sempre un problema impegnativo”, sostiene. I coloranti iniettati nei campioni hanno la tendenza a non penetrare molto bene, così la marcature non è uniforme: gli strati esterni saranno ben colorati, ma quelli verso il centro tenderanno a non essere ben marcati – se non addirittura privi di qualsiasi marcatura. “Con la GFP”, puntualizza Ernst, “possiamo essere sicuri che tutto il campione sarà marcato, perché il colorante è prodotto all’interno delle cellule”.
Un altro ricercatore dell’EMBL, Rainer Pepperkok, sostiente che “con la GFP possiamo davvero fare biologia molecolare all’interno delle cellule, mentre tutto è in movimento, anziché farla all’interno di una provetta”. Come altri ricercatori, approfitta del fatto che la GFP è ora disponibile in diversi colori e sfrutta un fenomeno fisico conosciuto come “trasferimento di energia in risonanza fluorescente” (FRET, dall’inglese “Fluorescent Resonance Energy Transfer).
Si ha FRET quando due molecole di diverso colore – solitamente una rossa e una verde – si trovano l’una vicina all’altra. Se la molecola verde riceve luce blu o ultravioletta, la assorbe e trasferisce parte della sua energia alla molecola rossa, che emetterà luce rossa, in modo simile a quanto succede nella medusa, dove la GFP si illumina di verde grazie alla luce blu emessa dall’equorina. “Se si hanno una proteina marcata con la GFP verde e un’altra con la GFP rossa”, spiega Rainer, “e se queste interagiscono tra di loro, la rossa sarà più brillante e la verde sarà più spenta”.
Nonostante i diversi usi della GFP, o forse proprio a causa loro, i ricercatori non sono ancora soddisfatti. Molti vorrebbero delle proteine fluorescenti che si illuminino se esposte a luce rossa o addirittura infrarossa, poiché questa penetra meglio i tessuti biologici. “Espanderebbe anche lo spettro dei colori disponibili”, puntualizza Jan Ellenberg, “cosa che ci permetterebbe di marcare più proteine e di seguirle tutte insieme”. Potrebbe essere necessaria una nuova scoperta per trasformare questo desiderio in realtà, visto che Jan crede che il modo classico di creare proteine fluorescenti che si illuminano a più alte lunghezze d’onda – aggiungendo più amminoacidi al fluoroforo – sia stato quasi completamente sfruttato.
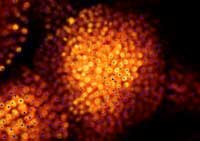
computer a marcatura con
GFP, i ricercatori possono
confrontare le loro predizioni
(in blu) con la reale
localizzazione dei nuclei
cellulari (in arancio)
Immagine cortesemente messa
a disposizione da Marcus
Heisler / EMBL
Da parte sua, Darren sostiene che le tecniche di microscopia necessitano di un adeguamento: “Al momento, siamo a un punto in cui possiamo creare zebrafish con cinque colori, ma poi non saremmo in grado di distinguerli con la maggior parte dei microscopi ora a disposizione”.
Nonostante ciò, la GFP si sta espandendo oltre i confini della scienza. È usata in alcuni giocattoli che si illuminano al buio, in pesci fluorescenti venduti come animali domestici e persino in batteri geneticamente modificati per individuare arsenico, TNT e metalli pesanti.
Malgrado tutti questi progressi, comunque, il mistero iniziale è ancora da risolvere: non sappiamo ancora perché mai la medusa abbia sviluppato la capacità di illuminarsi di verde.
References
Spinney L (2007) La grande migrazione. Science in School 7. www.scienceinschool.org/2007/issue7/migration/italian
Web References
- w1 – Per saperne di più sul Premio Nobel per la Chimica del 2008, si legga: http://nobelprize.org/nobel_prizes/chemistry/laureates/2008
- w2 – Si possono trovare più informazioni riguardo l’EMBL e i suoi ricercatori qui: www.embl.org





