Petite merveille : la chimie à micro-échelle dans la salle de classe Inspire article
Les bonnes choses viennent en petites quatités : découvrez comment les expériences à micro-échelle peuvent avoir un effet important sur l'enseignement des STIM.
Les expériences en classe sont nécessaires pour capter l’attention des élèves et illustrer les principes chimiques essentiels.
Cependant, les méthodes traditionnelles nécessitent souvent de grandes quantités de réactifs dangereux, un équipement complexe et beaucoup de travail pour l’enseignant ou les élèves en termes de préparation et de rangement. Nombre de ces expériences peuvent être facilement adaptées pour être réalisées à petite échelle, sans que cela ne nuise à l’effet démontré. En fait, les expériences à micro-échelle (parfois appelées petites échelles) peuvent même mettre en évidence des effets qui ne sont pas apparents lors de la réalisation d’expériences similaires à plus grandes échelles. Cet article présente le principe des expériences à microéchelle en classe et les raisons pour lesquelles vous devriez les essayer dans votre classe.
Qu’est-ce que c’est la chimie à micro-échelle ?
J’ai mis au point des procédures à micro-échelle au CLEAPSS[1] au Royaume-Uni, pour répondre aux préoccupations des institutions de l’enseignement secondaire concernant l’exposition des étudiants et des enseignants à des réactifs dangereux.
Très souvent, la chimie à l’échelle microscopique consiste à effectuer des réactions en gouttelettes. Cela peut se faire facilement en distribuant des gouttelettes (0,2 à 0,5 ml) de solutions sur une feuille de travail modèle qui est enfermée dans une pochette ou un dossier en plastique transparent (de préférence) ou plastifié (les corrections et les améliorations nécessitent plus de plastification).
La figure 1 montre une démonstration impliquant des indicateurs de pH et des solutions de différentes valeurs de pH. Cette démonstration est utilisée par le CLEAPSS dans le cadre de ses cours sur la santé et la sécurité destinés aux enseignants et aux techniciens britanniques. La beauté des couleurs et la rapidité avec laquelle elle peut être réalisée incitent les participants à reprendre les idées dans leurs écoles.

Image reproduite avec l’aimable autorisation de Bob Worley
D’autres réactions, incluant précipitations (figure 2) et déplacements de réaction, peuvent être réalisées de manière similaire.
Les réactifs peuvent être facilement appliqués à l’aide d’un petit compte-gouttes ou d’une pipette, ce qui permet de créer divers modèles pour illustrer différents schémas ou tendances. Les feuilles peuvent ensuite être facilement essuyées. Une autre approche consiste à placer des gouttelettes de réactifs sur des boîtes de Pétri (voir figure 5).
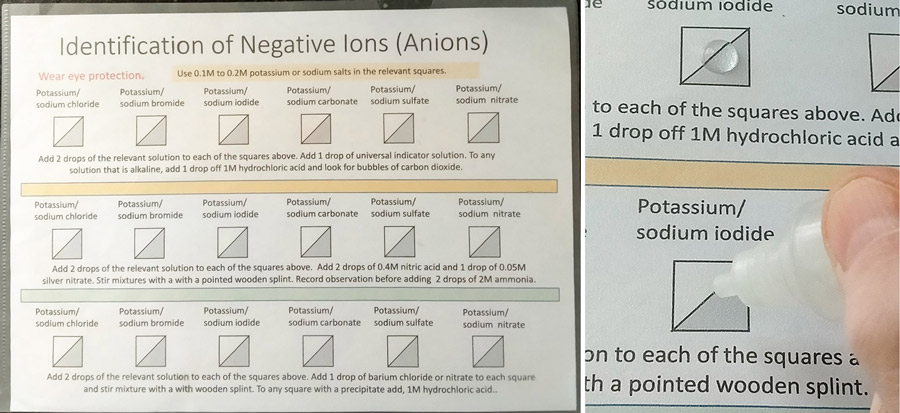
Image reproduite avec l’aimable autorisation de Bob Worley
Outre l’ajout de gouttes de solutions ou de réactifs liquides, les élèves peuvent fabriquer la solution in situ en ajoutant des grains de sel à un solvant à l’aide d’un cure-dent ou d’une attelle en bois. En raison du petit volume, la dissolution et le mélange sont très rapides, ce qui peut constituer en soi une excellente démonstration de la dissolution, de la solvatation et de la diffusion.
La figure 3 montre ce qui se passe lorsque de minuscules grains de sulfate de cuivre(II) et de carbonate de sodium sont ajoutés de chaque côté d’une goutte d’eau distillée. Les deux solides ioniques se dissolvent et diffusent dans l’eau, et une ligne de précipité de carbonate de cuivre basique se forme au centre de la goutte, là où les ions cuivre et carbonate se rencontrent.

Image reproduite avec l’aimable autorisation de Bob Worley
Un indicateur de conductivité peut également être utilisé sur les gouttes afin de détecter la présence d’ions et indiquer une électrolyse (Figure 4).

Image reproduite avec l’aimable autorisation de Bob Worley
Comment adapter l’expérience pour l’approche à micro-échelle ?
Idéalement, la version à micro-échelle devrait permettre d’obtenir plus d’informations à des fins pédagogiques que la forme traditionnelle de l’activité.
Le processus d’utilisation de gouttes de liquide sur une surface en plastique repose sur la tension superficielle, qui convient parfaitement aux solutions aqueuses mais ne fonctionne pas avec les liquides organiques. En outre, de nombreux plastiques sont ramollis par les solvants organiques tels que les cétones et les esters. Ainsi, pour les solvants organiques, il faut utiliser de petites fioles en verre, des plaques de porcelaine ou des tubes à essai.
Le chauffage peut être un problème, mais les liquides peuvent être placés dans un flacon en verre entouré d’eau bouillante provenant d’une bouilloire ou placés sur une plaque chauffante ou un dispositif de chauffage conçu sur mesure.[2]
Pourquoi devrais-je utiliser la chimie à micro-échelle dans ma classe ?
Cette approche présente de nombreux avantages, dont les principaux sont résumés ci-dessous.
Les avantages de l’approche à micro-échelle
- Améliorer la sécurité
- Réduire les déchets (minimise l’impact sur l’environnement)
- Réduction des coûts d’équipement/matériel
- Adapté aux environnements dont les ressources sont limitées, comme le montre le projet RADMASTE[3]
- Installation/rangement plus facile
- Les expériences sont plus rapides et plus faciles à réaliser:
- Les enseignants ont plus de temps pour enseigner.
- Les élèves peuvent se concentrer sur les principes clés.
- Améliorer la compréhension des concepts chimiques difficiles en remettant en question les idées fausses des élèves.
- Encourager de nouvelles expériences, par exemple l’hydrogénation des alcènes et la liquéfaction des gaz.
- Faciliter les initiatives STIM avec des matériaux et des méthodes modernes, comme les électrodes en fibre de carbone, les aimants Nd, les DEL, la microélectronique Arduino, l’impression 3D et la découpe laser.
En termes de sécurité, les avantages de l’utilisation de plus petites quantités de réactifs sont évidents. C’est particulièrement vrai pour les produits chimiques volatils, où les niveaux de toxicité des gaz dans l’air seront beaucoup plus faibles si les étudiants n’utilisent que des gouttelettes. Une excellente démonstration de ce phénomène est l’électrolyse du chlorure de sodium ou du chlorure de cuivre(II), qui produit un gaz chloré toxique pouvant provoquer des difficultés respiratoires. Certains employeurs voulaient que cette activité soit supprimée alors qu’elle était spécifiée dans les programmes d’examen. Cependant, le CLEAPSS a pu concevoir un équipement permettant de réaliser cette expérience à plus petite échelle (figure 5), et dans ce cas, seuls 5 à 6 cm3 de gaz chloré sont produits.
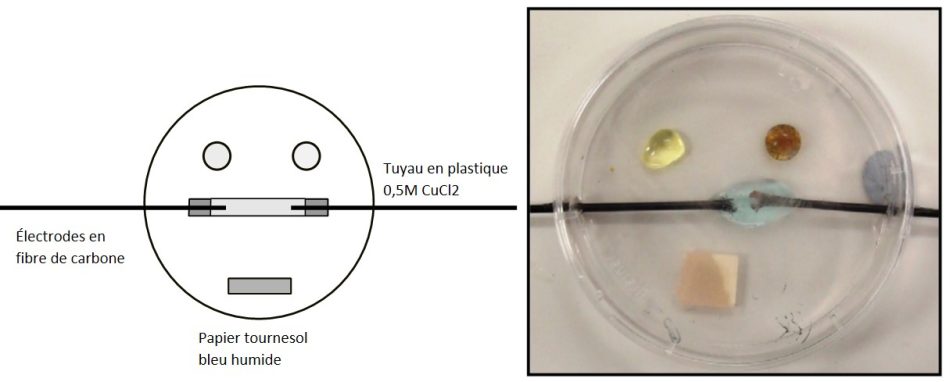
Image reproduite avec l’aimable autorisation de Bob Worley

Image reproduite avec l’aimable autorisation de Bob Worley
Certains enseignants craignent que les élèves soient désavantagés si le dispositif expérimental utilisé ne correspond pas à celui utilisé dans les examens. Cependant, ce problème peut généralement être résolu en fournissant un diagramme qui montre clairement l’équivalence avec les expériences classiques à plus grande échelle. Par exemple, pour l’expérience d’électrolyse décrite ci-dessus, un enseignant a convenu que la microélectrolyse était bonne mais s’est inquiété du fait que la conception ne reflétait pas l’appareil tel qu’il est présenté dans les manuels et les questions d’examen. Un technicien à l’esprit vif, a dessiné un « bécher horizontal » sur papier et a repositionné les électrodes, et l’enseignant était satisfait.
Les avantages des expériences rapides et faciles à réaliser sont peut-être moins évidents que les avantages pratiques en termes de commodité et de sécurité. Cela réduit la charge sur la mémoire de travail à court terme des élèves et leur permet de mieux s’engager à la fois dans l’excitation de l’expérience et dans la science qui en découle. La nature de l’expérience à micro-échelle peut également faciliter la compréhension des principes scientifiques. Par exemple, dans l’expérience de précipitation du carbonate de cuivre présentée ci-dessus, les élèves voient les solides être ajoutés et comprennent comment ils se dissolvent et se rejoignent au milieu. En revanche, lorsqu’ils mélangent deux solutions préparées par l’enseignant, l’apparition soudaine d’un précipité solide peut sembler magique.
Résumé
Il y a bien d’autres choses encore à ajouter. Si cet article a suscité votre intérêt, je vous encourage à regarder la récente conférence qu’Adrian Allan et moi-même avons donnée dans le cadre de Science on Stage [4], ainsi que l’autre vidéo de la section des ressources. Dans les prochains numéros de Science in School, d’autres articles “Teach” seront publiés avec des instructions étape par étape sur la manière de réaliser certaines de ces expériences à micro-échelle, ainsi que des ressources imprimables.
References
[1] Une introduction sur CLEAPSS: http://science.cleapss.org.uk/Policies/What-Is-Cleapss.aspx
[2] Allan A, Worley B, Owen M (2018) Perfumes with a pop: aroma chemistry with essential oils. Science in School 44:40–46.
[3] Plus d’informations sur le RADMASTE Microscience: https://www.radmaste.org.za/
[4] Science on Stage rassemble des enseignants STIM avec des idées d’enseignement exceptionnelles: https://www.science-on-stage.eu/
Resources
- Regardez une conférence récente de Science on Stage présentant de fantastiques expériences de chimie à micro-échelle.
- Regardez cette excellente introduction aux techniques de chimie à micro-échelle.
- Voir une expérience avec des gaz liquéfiés.
- Apprenez à isoler les huiles essentielles des plantes odorantes : Allan A, Worley B, Owen M (2018) Perfumes with a pop: aroma chemistry with essential oils. Science in School 44:40-46.
- Essayez de faire des expériences avec des sphères d’hydrogel : Tarai ED (2017) Small is beautiful: microscale chemistry in the classroom. Science in School 39:31-35





