Plásticos, naturalmente Understand article
Traducido por I. Carrero, Univ. de Valladolid. Nos sentamos sobre ellos, los usamos continuamente y hasta cocinamos con ellos: los plásticos están por todas partes. Sin embargo, su versatilidad y su abundancia hacen todavía más difícil producirlos y eliminarlos de manera medioambientalmente…

Imagen cortesía de la
Universidad de Manchester
El pequeño juguete de plástico de tu caja de cereales para el desayuno es una nimiedad. Sin embargo, la eliminación anual de millones de toneladas de plásticos usados es un problema creciente que requiere una discusión más seria que una charla sobre los copos de maíz. El trabajo del jefe de equipo Colin Webb y de sus colaboradores Ruohang Wang y Apostolis Koutinas en el Satake Centre for Grain Process Engineering (Centro Satake de Ingeniería de Procesamiento de Cereales) de la Universidad de Manchester trata de conseguir una solución óptima que no solo promete resolver el problema de la eliminación de los plásticos sino que también dará paso a nuevas formas de manufacturación sostenible.
Con el apoyo del Engineering and Physical Sciences Research Council, EPSRCw1, (Consejo de Investigación de Ciencias Físicas e Ingeniería) los investigadores combinan procedimientos de ingeniería y biotecnología con la química de cereales para desarrollar alguna técnica nueva y eficiente que permita transformar los granos de cereales en bioplásticos biodegradables. También están desarrollando técnicas de procesado para eliminar el salvado del grano –denominado proceso de «perlado»– que funcionarán como una herramienta común para extraer compuestos útiles de un amplio abanico de cereales; estos compuestos se podrán usar como precursores de nuevos materiales.

técnica conocida como
«perlado» del grano, los
investigadores tratan de
eliminar las envueltas
externas de las semillas que
entonces se pueden moler
para dar harina – generando
así un material de partida
cargado de nutrientes y
enzimas que los
microorganismos adecuados
utilizarán para producir
bioplásticos
Imagen cortesía de la
University of Manchester
Aparte de otros componentes funcionales, esos precursores incluyen azúcares de cadena corta (oligosacáridos), para fermentaciones; arabinoxilanos, para aplicaciones médicas; o ácido ferúlico (precursor de compuestos aromáticos, como la vanillina), con propiedades antioxidantes.
Cómo reducir los residuos
Los plásticos han revolucionado la vida moderna proporcionándonos desde las medias de nylon a los mordedores de PVC (cloruro de polivinilo; N. del T.) además de los condones hipoalergénicos de caucho sintético. Los plásticos son derivados petroquímicos por lo que, con una producción anual de quinientos millones de toneladas, dependemos de los hidrocarburos fósiles para su fabricación. Además, el hecho de que muchos plásticos no sean reutilizables hace que constituyan un importante problema medioambiental debido a que los productos petroquímicos no se degradan de forma natural. Los plásticos desechados se pueden eliminar por incineración pero así se generan muchos contaminantes.
La posibilidad del reciclaje conlleva el problema de que hay que limpiar, clasificar y buscar aplicaciones a los materiales de menor calidad que se obtienen. Por desgracia, el enterramiento acaba siendo la forma más barata y segura de eliminación y el resultado es que, con el 40% de los plásticos producidos ya enterrados en los vertederos, estos se están llenando. «Los problemas medioambientales, la mayor demanda de energía, ciertas cuestiones políticas y el agotamiento a medio plazo de las reservas de petróleo han hecho surgir la necesidad de desarrollar tecnologías sostenibles basadas en materias primas renovables», dice Colin. Junto con sus colaboradores, espera encauzar este asunto hacia el desarrollo de materias primas alternativas para una industria del plástico basada en cultivos de cereales renovables en vez de en nuestras limitadas reservas de petróleo. «La selección de la materia prima más adecuada para abastecer procesos sostenibles depende de factores infraestructurales, económicos y tecnológicos como su disponibilidad, la necesidad de mano de obra cualificada y de técnicas de pretratamiento para su procesamiento, de los costes y del transporte», explica Apostolis. «Los cereales son de las pocas materias primas renovables que satisfacen la mayoría de esos requisitos previos». Los granos de cereal son lo suficientemente nutritivos como para ser el caldo de cultivo de microorganismos, como Aspergillus awamori, y esto se puede aprovechar para desarrollar métodos genéricos para refinar el grano de partida utilizando la fermentación microbiana y convertirlos químicamente, o a través de más pasos fermentativos, en biocombustibles, productos químicos y bioplásticos (plásticos no derivados del petróleo sino de origen vegetal).

Universidad de Manchester
creen que, con el uso de
microorganismos
productores de plástico, los
campos de trigo podrían
reemplazar los hidrocarburos
fósiles como origen de
muchos plásticos
Imagen cortesía de David
Bradley
La idea tiene muchas ventajas, sobre todo porque los cultivos son un recurso renovable y el usarlos es un proceso neutro en cuanto a la producción de carbono. Además, los productos de la química de cereales, incluyendo los bioplásticos, serán biodegradables y al descomponerse solo producirán agua y dióxido de carbono: una gran diferencia con los 10 000 años de vida media del PVC y el polietileno. También hay muchas ventajas socioeconómicas en el desarrollo de los cereales como fuente de materias primas, incluyendo una menor dependencia de las menguantes reservas de petróleo y beneficios para los agricultores debido al aumento de su cultivo.
En la actualidad, hay tres vías para producir bioplásticos. La primera implica la producción intracelular por fermentación de derivados de cereales o de otros cultivos; esta forma requiere pasos de extracción y purificación. La segunda manera implica la modificación de plantas por ingeniería genética para que el plástico sea producido por las propias plantas; esto requerirá después la recolección de la planta y la purificación del plástico. Por último, se puede conseguir que los cereales produzcan precursores mediante fermentación y después estos precursores serán procesados para dar los bioplásticos. Si no hay microorganismos que puedan producir el bioplástico deseado, habrá que obtenerlos mediante ingeniería genética.
Microbios inteligentes
Los microbios que producen plástico utilizan azúcares sencillos, por ejemplo glucosa, como fuente de carbono y compuestos nitrogenados orgánicos, como aminoácidos y péptidos cortos, para obtener nitrógeno. Todos estos nutrientes se encuentran en el grano de los cereales. Además, los granos también contienen vitaminas y minerales esenciales para el crecimiento microbiano. Algunos granos tienen el potencial de producir compuestos químicos funcionales. El trigo, por ejemplo, destaca porque contiene compuestos útiles como aglutininas, ciertos lípidos, arabinoxilano, ácido fítico, vitaminas y oligosacáridos. El perlado del grano para eliminar las envueltas externas de las semillas y su molienda posterior para dar harina producen un material de partida con nutrientes y enzimas que permiten que se alimenten de él algunos microorganismos adecuados para producir bioplásticos. «Esta estrategia de biorrefinación proporciona una materia prima óptima para fermentaciones microbianas posteriores encaminadas a producir bioplásticos y otros compuestos químicos», dice Colin.
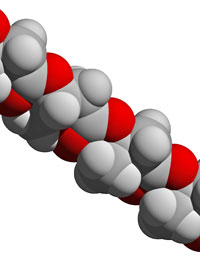
polímeros biodegradables
como el PHB
(polihidroxibutirato –cuya
estructura se muestra aquí–)
son costosos de producir y
no son adecuados para
muchos usos. Los
investigadores del EPSRC
esperan encontrar una vía
barata para tener plásticos
«verdes» y más versátiles
Imagen cortesía de David
Bradley
«Los bioplásticos microbianos tendrán muchas aplicaciones como plásticos desechables, por ejemplo para envasar alimentos, pues ahí no puede haber reciclaje».
Colin Webb, profesor
No será posible desarrollar métodos de procesado que produzcan plásticos para todas las aplicaciones pero los investigadores esperan cubrir las más básicas. «Los bioplásticos microbianos tendrán muchas aplicaciones como plásticos de un solo uso, como los que se emplean para empaquetar alimentos, que no se pueden reciclar. También es posible mezclar plásticos con otros materiales para hacer bioplásticos resistentes a la degradación. Adicionalmente, se puede desarrollar el reciclado como una metodología general para la producción de plásticos más duraderos», añade Colin. El procesamiento convencional de los granos para producir sirope de maíz y otros alimentos y productos para la alimentación animal genera muchos desechos, consume agua, es caro y no aprovecha la riqueza química de esos productos naturales –incluyendo sus innumerables nutrientes y enzimas–. Con sus nuevos procesos, el equipo de Manchester pretende explotar todo el potencial de los cereales integrales para crear refinerías viables para la producción de bioplásticos y también de otros productos con valor añadido. Este enfoque busca nuevas aplicaciones en el mercado.
«El gluten, por ejemplo, se podría utilizar como un bioplástico con muchas posibilidades de uso», dice Apostolis, «mientras que los arabinoxilanos tendrían aplicaciones médicas y así no se desperdiciaría ninguno de los productos secundarios de los granos de cereal». Colin añade: «La industria actual de producción de plásticos tendrá que ir sustituyendo gradualmente los productos petroquímicos que usa por fuentes renovables basadas en la biomasa. El agotamiento inminente de los recursos petrolíferos forzará este cambio», dice, «esto hace de los cereales el candidato más destacado para ser la materia prima de la producción de bioplásticos». De acuerdo con Colin, el éxito de esta empresa dependerá de colaboraciones con industrias y otras instituciones académicas que puedan aportar su experiencia en: necesidades de mercado, procesamiento a escala industrial, aspectos químicos, cultivo de cereales y análisis de ciclos de vida. Colin comenta: «La forma en que se ha orientado este proyecto busca mejorar el aspecto económico de la producción de bioplásticos por fermentación bacteriana, ya que este aspecto es uno de los principales condicionantes del proceso». Si tienen éxito, los muñecos de plástico de tu caja de cereales serán algún día tan sostenibles como los propios cereales.
Web References
- w1 – El EPSRC financia investigaciones y formación para posgraduados en ingeniería y en ciencias físicas en universidades y otras instituciones por todo el Reino Unido.
Review
La fabricación de plásticos no se incluye en los temarios de ciencias, pero este artículo explora uno de esos aspectos marginales de la ciencia que es muy importante para cuestiones relacionadas con el desarrollo social.
En estos días, la sostenibilidad de los recursos naturales y el calentamiento global derivado de la actividad humana son los principales factores limitantes para cualquier modelo de desarrollo social. Mientras que algunos grupos hablan de la energía nuclear o del desarrollo de fuentes de energía alternativas, Bradley demuestra que los avances en el uso eficiente de los recursos renovables pueden tener consecuencias positivas.
El artículo habla de eficiencia, sostenibilidad, reducción de nuestra huella de carbono, recursos naturales y estructura social. Además, destaca cómo la especialización científica (a menudo criticada) hace que sean posibles avances en áreas de conocimiento minoritarias que, sin embargo, pueden llegar a ser muy útiles.
Para el aula, el artículo tiene una aplicación interdisciplinar. Las ciencias ambientales y los profesores de educación ambiental, tanto en la escuela secundaria como en niveles anteriores, lo pueden usar para ilustrar y trabajar conceptos básicos como la sostenibilidad, la influencia humana sobre los procesos del ciclo del carbono, los cambios en la estructura social o la importancia de la agricultura y de la conservación del suelo.
Algunas actividades relacionadas con el artículo pueden ser:
- Los estudiantes pueden trabajar sobre un índice de sostenibilidad sencillo para diferentes recursos (plásticos convencionales, bioplásticos, suelos agrícolas, fertilizantes basados en nitratos, madera y productos forestales, aceites, biocombustibles, etc.) y utilizarlo para discutir sobre sus consecuencias ambientales
S = NGa x (1 +RCr +RUr)
HUa + DaDonde: NGa = Producción natural (Natural genesis amount), masa/tiempo
RCr = Tasa de reciclaje (Recycling rate), adimensional (de 0 a 1)
RUr = Tasa de reutilización (Re-use rate), adimensional (de 0 a 1)
HUa = Uso humano (Human use amount), masa/tiempo
Da = Degradación (Degradation amount), masa/tiempo
- Los estudiantes pueden trabajar sobre modelos sencillos del ciclo del carbono introduciendo los efectos de los bioplásticos o de los biocombustibles.
- El artículo menciona la influencia de los bioplásticos en la relación entre las estructuras agrícola e industrial. Los profesores pueden correlacionar los conceptos de biodiversidad y diversidad social con su influencia sobre la estabilidad y la supervivencia de ecosistemas y sociedades.
- Los bioplásticos (y los biocombustibles) dependen de la agricultura y del suelo. Los profesores pueden explorar la importancia de la conservación del suelo y de su erosión o contaminación.
- Los estudiantes pueden evaluar la tasa o cantidad de plástico desechable del aula y la huella de carbono del grupo. Después, pueden estimar los efectos sobre su huella de carbono de la sustitución de los plásticos convencionales por los bioplásticos.
- Los profesores pueden ayudar a sus estudiantes a representar diagramas de flujo paralelos para los procesos implicados en la producción y la eliminación de distintos productos: botellas de bioplástico frente a las de plástico petroquímico, mesas de metal frente a las de madera, gasoil frente a biocombustibles.
- Los profesores también pueden utilizar preguntas indirectas para conocer de qué manera pueden influir los bioplásticos en nuestras vidas. Aquí hay algunos ejemplos: ¿cómo pueden ayudar los bioplásticos a salvar los glaciares antárticos?, ¿cómo pueden ayudar los bioplásticos a evitar el aumento del nivel de los mares?, ¿cómo pueden los bioplásticos salvar a los pájaros que viven en los vertederos de basura de tu ciudad?
Juan de Dios Centeno Carrillo, España





