DNA’da Urasil: bir yanlışlık mı ya da sinyal mi? Understand article
Tercüme eden: Selen Çolak ve Hikmet Geçkil (İnönü Üniversitesi, Moleküler Biyoloji ve Genetik Bölümü). Urasil RNA da kullanılan bazlardan biridir. Ancak, bu baz neden DNA’da kullanılmaz (ya da kullanılıyor mu?) Angéla Békési ve Beáta G Vértessy araştırdı.
Urasile karşı Timin
Genetik bilgimiz dört harfli bir alfabe kullanılarak DNA’da saklanır. Bu dört harfe karşılık gelen, her biri DNA yapıtaşı olan dört kimyasal baz (nükleotid olarak adlandırılırlar): adenin(A), timin(T), sitozin(C) ve guanine(G; bkz. Şekil 1) sahip olabilir. James Watson ve Francis Crick’in ünlü keşfi DNA’nın çift sarmallı yapısında dört baz her zaman aynı şekilde aralarında özel hidrojen bağları kurularak eşleşir: adenin timine ve guanine de sitozine bağlanır(bkz. Şekil 2 ve 3).
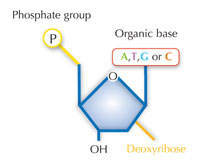
Resim: Nicola Graf’ın izniyle
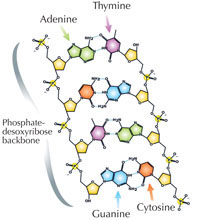
Resim: Madeleine Price Ball’ın izniyle; Resim kaynağı: Wikimedia Commons
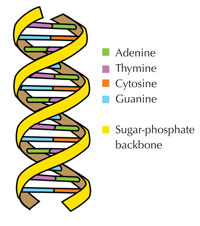
Resim: Forluvoft’ın izniyle; Resim kaynağı: Wikimedia Commons
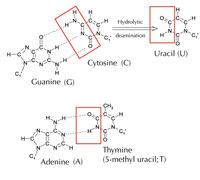
Ancak, alternatif bir beşinci harf vardır: adeninle aynı model hidrojen bağı oluşturan urasil (U) (bkz. Şekil 4). Ama urasil yaygın olarak ve sorunsuz bir biçimde RNA’da kullanılsa da, DNA için aynı durum geçerli değildir. DNA’da urasil yerine timin kullanılır. Bu neden olabilir?
Resim: Angéla Békési’nin izniyle
Kimyasal olarak timin, fazladan bir metil grubu eklenmiş bir urasil molekülüdür. Evrimsel süreçte, bu daha karmaşık yapıtaşının DNA’da kullanılmasının avantajı ne olurdu? Cevap belki de hücrelerin DNA hasarlarını nasıl düzeltiğinde yatıyordur.
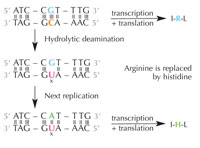
deaminasyonu dizilimde
kodlanan amino asitleri
değiştirebilir. Büyütmek için
resmin üzerini tıklayınız
Resim: Nicola Graf’ın izniyle
Sitozin kendiliğinden hidrolitik deaminasyon adlı bir işlem geçirerek urasile dönüşebilir (bkz. Şekil 4). Bu olurken, başlangıçta o sitozine bağlı olan guanin karşı taraftaki urasile karşı gelir (unutmayın urasil normalde adenine bağlanır). Hücre, daha sonra DNA’sını kopyalarken, bu urasil molekülünün karşısındaki guanin olması gereken yere bir adenin yerleştirilebilir ve böylecebu bölgedeki DNA mesajı değişebilir (bkz. Şekil 5). Sitozin deaminasyonu en iyi bilinen DNA hasar çeşitlerinden biridir, ama normolde etkin biçimde düzeltilir. Hücre bunu nasıl yapar?
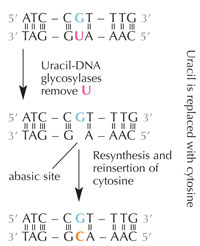
deaminasyon onarımı.
Büyütmek için resmin üzerini
tıklayınız
Resim: Nicola Graf’ın izniyle
Hücreler, sitozinin olması gereken yere bir urasil yerleştiği zaman bunu bulabilen bir onarım sistemine sahiptir ve kopyalanıp geçmeden önce bu yanlış düzeltilir. Bunu yapan karmaşık mekanizma çeşitli enzimleri içerir: önce urasil-DNA glikozilaz urasili tanır ve DNA’dan keser. Sonra DNA’daki boş kısımların bir sitozin ile yer değiştirmesi sırasında, çeşitli enzimler katılarak DNA’nın zarar görmüş kısımları çıkarılır ve yeniden sentezlenir (bkz. Şekil 6).
Ancak, en yaygın urasil-DNA glikolaz formu urasilin hangi bazla eşleşeceğini söylemez. Urasil bağlanması gereken yerde ise (yani adeninle bağlanmışsa) ya da mutasyona uğramış bir sitozinse (ve guaninin karşısındaysa); bunun yerine, o urasilin her iki çeşidini de tanır ve keser. Fakat, bu problemlere sebep olabilir. Bu potansiyel problemin düzeltilmesi metil grubuyla etiketlenmiş vetiminle sonlanan, doğru urasilin (adeninle eşleşmiş) bulunduğu evrim mekanizmasında düşünülebilir. Bu şekilde, hücre düzeneği bir urasil bulursa, onu keser ve onarır. Ancak, hücredeki aynı mekanizma metil grubu taşıyan bir urasil (tani timin) bulursa ona karışmaz (bkz. Şekil 4). Zamanla, bu yüzden DNA’daki timin urasilin yerine standart bir baz olur ve birçok hücre şimdi urasili sadece RNA’da kullanır.
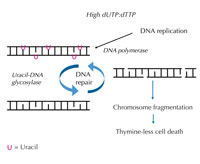
artarsa, DNA polimeraz
kopyalama ve onarımın her
ikisinde de düzenli
olarak,timin yerine urasil
dahil eder. Urasil-DNA
glikozilaz urasili uzaklaştırır
ve ayrıca DNA zincir
kırılmasını içeren bir ara
evrede onarımı başlatır.
Ancak, sentez onarımı, urasili
yeniden getirebilir, verimsiz
bir DNA onarım döngüsüne
yol açabilir. Sonunda,sistem
aşırı yüklenmiş olur ve
kromozom fregmantasyonu
oluşurak hücre ölümüne yol
açar. Büyütmek için resmin
üzerini tıklayınız
Resim: Angéla Békési’nin
izniyle
Niçin urasil RNA’da tutulur? RNA, DNA’dan daha kısa ömürlüdür ve (birkaç istisna dışında) genetik bilgiyi uzun süre saklayamaz. Zaten RNA’da kendiliğinden urasillere dönüşen sitozin molekülleri hücre için büyük bir sorun yartamazlar. Bundan dolayı büyük olasılıkla urasilin, daha karmaşık (hatta sentezi dha pahalıya patlayan) timinle yer değiştirmesi için evrimsel bir baskı yoktur.
Timinsiz hücre ölümü
DNA sentezlenirken, sentezi katalizleyen DNA polimeraz enzimleri timin ile urasil arasında ayrım yapamaz. Sadece hidrojen bağlarının doğru bağlanıp bağlanmadığını, yani baz çifterinin düzgün biçimde eşlenip eşlenmediğini kontrol eder. Bu enzimler için, adenine timin ya da urasilin bağlanması sorun olmaz. Normalde, hücredeki deoksiüridin trifosfat (dUTP, bir urasil kaynağı), deoksitimidin trifosfata (dTTP, bir timin kaynağı) kıyasla çok düşük seviyede tutulurak, urasilin DNA sentezine katılımı engellenir.
Eğer bu titiz düzen bozulursa ve dUTP’nin dTTP’ye oranı artarsa, yanlışlıkla DNA’ya katılan urasil miktarı da artar. Sonra, DNA polimerazdan farklı olan bir onarım sistemi urasil ile timinden ayırt edebilir ve urasil-DNA glikozilaz enzimi yardımıyla urasili keserek DNA omurgasının geçici olarak kesilmesini ve DNA’nın yeniden sentezini sağlar. Ancak, dUTP’nin dTTP’ye oranı hala yüksekse, bu yeniden sentezleme timinin yerine tekrar urasilin girmesine sbep olabilir. Bu döngü, geçici olarak ardarda sıralanan ve birbirlerine yakın DNA kesik parçalarından dolayı (bkz. Şekil 7), DNA zincir kırıklarına ve kromozom fregmantasyonuna yol açar. Bu durum, timinsiz hücre ölümü adı verilen özel bir çeşit hücre programlı hücre ölümü ile sonuçlar.
Bu timinsiz hücre ölümü işlemi kasıtlı olarak kanser tedavilerinde kullanılır. Çünkü kanser hücreleri normal hücrelere kıyasla öylesi yüksek oranda çoğalırlar ki, belli birim zamanda yüksek bir miktarda DNA sentezlerler ve bu yüzden çok miktarda dUTP’ye gereksinim duyarlar. dUTP’nin dTTP’ye oranı arttırılarak kanser hücreleri seçici olarak hedeflenir ve elimine edilirler.
Urasil DNA hala var
Çoğu hücrede urasil RNA’da ve timin DNA’da kullanılmasına rağmen, istisnalar da vardır. Bazı organizmalar, tüm DNA’larında timin yerine urasile sahipken, bazı organizmalar sadece bazı DNA’larında urasile sahiptir. Peki bunun evrimsel avantajı ne olabilir? Bazı örneklere bir bakalım.
Viral (virüsle ilgili) DNA da Urasil
hücresini enfekte etmesinin
resmedilmiş hali
Resim: cdascher /
iStockphoto’nun izniyle
İki tür faj (bakterileri enfekte eden virüsler) sadece urasil içeren (timinin içermeyen) DNA genomlarına sahiptir. Bu fajların timinsiz DNA’sının geçmişteki yaşam formarında da olup olmadığı, yoksa sadece urasil içeren genomların daha sonra evrimsel süreçte mi ortaya çıktığını henüz bilmiyoruz. Benzer biçimde, bu fajların neden timin yerine urasili kullandığını da bilmiyoruz. Ancak, bu durum fajların yaşam döngülerinde zorunlu bir rol oynuyor olabilir. Durum buysa, bu virüslerin DNA’larında urasilin yerine timinin koyulmaması bir anlam ifade edecektir. Bu bağlamda, bu fajlardan birinin konak hücrenin urasil-DNA glikolazını inhibe eden bir proteini kodlayan bir gene sahip olduğu ve böylece viral genomun, konak hücrenin enzimleri tarafından urasil onarımını engelledikleri anlaşılmaktadır.
Böcek yaşam döngülerinde programlı hücre ölümü

endopterygotlarda DNA’daki
urasili çıkran enzim
bulunmaz
Resim: spxChrome /
iStockphoto ve Nicola Graf’ın
izniyle
Urasil-DNA’nın, endopterygot böceklerinin yaşam döngülerinde pupa devresi geçiren (örn., karıncalar ve kelebekler) ve geçirmeyenlerin (örn., çekirgeler ve termitler) gelişiminde rol oynadığı görülür. Bu böcekler, DNA’daki urasili çıkaran urasil-DNA glikozilaz genini içermezler
Ayrıca, kendi araştırmalarımız gösteriyor ki, meyve sineği Drosophila melanogaster larvasındaki dUTP’nin dTTP’ye oranı, alışılmadık bir biçimde düzenlenir: yetişkin böceklerde gerekli olmayacak tüm dokularda, dUTP’yi yıkan ve dTTP üretimi için bir haberci oluşturan enzim çok daha düşük seviyelerdedir. Sonuç olarak,önemli miktarda urasil, DNA sentezi boyunca bu dokulara dahil edilir
Böylece larva evresi boyunca, urasil-DNA üretilir ve pupal evre boyunca parçalanacak dokularda düzeltilmemiş olduğu görülür. Bu böceklerde pupal evrede urasil-DNA glikolaz enzimi eksik olduğundan, ek urasil-DNA-özel faktörleri urasil yığılmasını bir sinyal olarak algılayarak hücre ölümünü başlatabilir. Urasil-DNA’yı parçalayan böceklere özgü bir proteini belirledikten sonra, bu enzimin programlı hücre ölümünü başlatmada bir rolü olup olmadığını arştırıyoruz.

urasilin varlığı antikor
protein çeşitliliğini arttıran
etkiye sahip bir DNA onarım
tepkisini sağlar. Geniş bir
antikor havuzu bağışıklık
sisteminin istenmeyen
istilacıları tanıma olasılığını
arttırır
Resim: taramol /
iStockphoto’nun izniyle
Yararlı yanlışlar: omurgalı bağışıklık sistemi
DNA’da urasil bizim gibi omurgalıların bağşıklık sisteminde bir role sahip olabilir. Bağışıklık sistemimizin bir kısmını oluşturan adaptif (kazanılmış) bağışıklık, bizi bir seri özel patojenlerden (hastalık etmeni) koruyan büyük çeşitlilikte antikorlar üretir. Farklı antikorların sayısını arttırmak için, onları kodlayan bölgelerdeki DNA dizilimini değiştiririz. Bunu, sadece hali hazırda hücrelerde var olan dizileri yeniden bir araya getirerek değil, aynı zamanda hipermutasyon olarak bilinen bir mekanizma ile mutasyon oranını arttırarak ürtemiş olduğumuz yeni dizlerle başarırız.
Hipermutasyon özel bir enzimle (aktivasyon-uyarıcı bir deaminaz) ile başlar. Bu enzim özel DNA lokuslarında sitozini urasile çevirerek (bkz. Şekil 4) hata-eğilimli onarım cevabını başlatır. Organizma bunu kendisi için avanyaj olarak kullanır: “hatalar” farklı antikorları yapabilen yeni dizilimler oluşturur. Bu sistem çok katı şekilde düzenlenir. Bu düzenlenme, kontrol edilmezse kansere yol açabilir.
Neden urasil ya da neden timin sorusunu düşünürken, bunu evrimsel bağlamda düşünmemiz gerekir. Canlı organizmalar sürekli değişen bir çevrede bir dizi dinamik meydan okumaya karşı gelişirler. Bu nedenle, DNA’ya eklenen hatalardan kaçınmak için bir çözüm birçok organizma ve hücrelerin çoğu için avantaj taşır. Bu, timinli DNA’nın neden norm olduğunu açıklar. Ancak belli koşullar altında, hala DNA’larında urasil kullan bazı hücreler için yanlışlar kendilerine yararlı olabilir.
Resources
- Beáta Vértessy’nin araştırma ekibinin çalışmaları hakkında daha fazla bilgi edinmek için: www.enzim.hu/~vertessy
- Villő Muha’nın Beáta Vértessy’nin akademik danışmanlığında yazılan ve Drosophila melanogaster’deki urasil-DNA odaklı PhD (doktora) tezinin bir özetini indirmek için: http://teo.elte.hu/minosites/tezis2010_angol/v_muha.pdf
-
Tezin tamamı için: http://teo.elte.hu/minosites/ertekezes2010/muha_v.pdf
-
Review
Bu makale, urasilin yalnızca RNA’da bulunduğu dogmasını sararak bilimin asla uyumadığını gösterdi. Makalede açıklandığı gibi, bu her zaman olan bir durum değildir. Ve bu oluyorsa bile, neden olabilir?
Bu sorular öğrencilerin bu makaleyi anlamalarına yardımcı olabilir:
- DNA’da iki tamamlayıcı baz çifti arasındaki bağlanma yapısını tanımlayınız.
- Hangi bazlar RNA’da yer değiştirir?
- DNA’da urasil bulunduğunda başlatılan enzim onarım mekanizmasını tanımlayınız ve bir grafiğini çiziniz.
- Kanserli hücrelerin gelişimini ve bölünmesini durdurmayı ayarlayan moleküllerin oranı nasıl ayarlanabilir?
- Urasil neden RNA’da tolere edilir?
- Hangi canlı organizmalar DNA’da urasil kullanır ve neden?
Friedlinde Krotscheck, Avusturya





