Uracile nel DNA: errore o segnale? Understand article
Tradotto da Attilia Dente. L’uracile è conosciuta come una delle basi usate nell’RNA, ma perché non è usata nel DNA? O lo è? Angéla Békési e Beáta G Vértessy indagano in merito.
Timina versus uracile
Le nostre informazioni genetiche sono conservate sotto forma di DNA, avvalendosi di un alfabeto di quattro lettere. Le quattro “lettere” corrispondono alle quattro basi chimiche che possono costituire un blocco di DNA ‒ detto nucleotide: adenina (A), timina (T), citosina (C) e guanina (G, v. figura 1). Come hanno scoperto James Watson e Francis Crick, il DNA forma una doppia elica in cui le quattro basi si uniscono sempre allo stesso modo mediante specifici legami ad idrogeno: l’adenina si lega alla timina e la guanina alla citosina (v. figura 2 e 3).
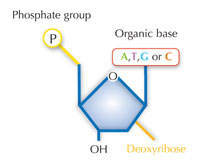
Immagine gentilmente concessa da Nicola Graf
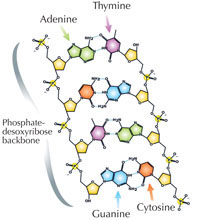
Immagine gentilmente concessa da Madeleine Price Ball; immagine tratta da: Wikimedia Commons
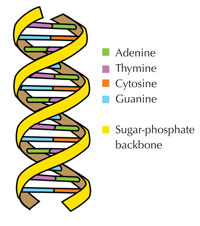
Immagine gentilmente concessa da Forluvoft; immagine tratta da: Wikimedia Commons
Tuttavia esiste una quinta lettera alternativa: l’uracile (U) che forma la stessa struttura di legami ad idrogeno con l’adenina (v. figura 4). Nonostante però l’uracile sia comunemente usato nell’RNA, non lo è nel DNA, dove invece troviamo la timina. Perché potrebbe essere così?
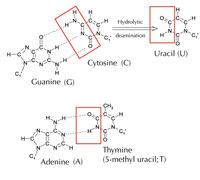
Immagine gentilmente concessa da Angéla Békési
Dal punto di vista chimico, la timina è una molecola di uracile con un gruppo metile extra attaccato. In termini evoluzionistici, quale sarebbe il vantaggio se si usasse questo più complesso blocco costitutivo nel DNA? La risposta potrebbe trovarsi nel modo in cui le cellule riparano i danni del DNA.
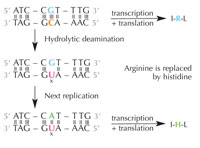
idrolitica della citosina può
modificare gli aminoacidi
decodificati dalla sequenza.
Cliccare sull’immagine per
ingrandirla
Immagine gentilmente
concessa da Nicola Graf
La citosina può spontaneamente trasformarsi in uracile attraverso un processo chiamato deaminazione idrolitica (v. figura 4). Quando ciò accade, la guanina, che inizialmente era legata a quella molecola di citosina, si unisce all’uracile (ricordate che di norma l’uracile si unisce all’adenina). Quando poi la cellula duplica il suo DNA; la posizione opposta a questa molecola di uracile viene occupata dall’adenina invece che dalla guanina, che dovrebbe trovarsi lì. In tal modo viene alterato il messaggio che è decodificato da questa sezione di DNA (v. figura 5). Questo processo di deaminazione della citosina è uno dei danni al DNA più comuni. Di norma, però, viene riparato efficacemente. In che modo le cellule attuano questa riparazione?
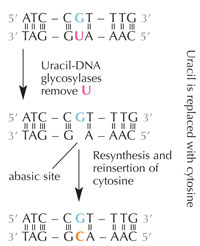
deaminazione idrolitica.
Cliccare sull’immagine per
ingrandirla
Immagine gentilmente
concessa da Nicola Graf
Le cellule hanno un sistema di riparazione che rileva quando un uracile siede al posto della citosina e correggono l’errore prima che venga duplicato e trasferito. Per poter fare ciò, questo complesso meccanismo si avvale di numerosi enzimi: innanzitutto l’uracil-DNA glicosilasi individua l’uracile e lo elimina dal DNA. Poi, i numerosi enzimi contribuiscono ad eliminare e risintetizzare le parti di DNA danneggiate. Durante questo processo, il posto abasico (“vuoto”) nel DNA è sostituito dalla citostina (v. figura 6).
Comunque, la forma più comune di uracil-DNA glicosilasi non può dire quale sia la base con cui l’uracile si combina, ossia se effettivamente l’uracile doveva essere lì (se legato all’adenina) o se si tratta di una citosina mutata (e si trova di fronte alla guanina); invece individuerebbe ed eliminerebbe entrambi i tipi di uracile. Chiaramente ciò potrebbe causare dei problemi. Si è pensato che la soluzione a questo potenziale problema potesse essere l’evoluzione di un meccanismo in cui le uracili “corrette” (accoppiate all’adenina) sono state etichettate con un gruppo metile ‒ che ha come risultato la timina. In tal modo, se il meccanismo cellulare ha rintracciato un uracile, lo ha eliminato e riparato, ma se ha trovato un uracile con un denominazione metile ‒ una timina (v. figura 4), l’ha lasciato. Comunque, con il tempo. la timina nel DNA, al posto dell’uracile, è diventato lo standard, e ora la maggior parte delle cellule usano l’uracile soltanto nell’RNA.
Perché si è mantenuto l’uracile nell’RNA? L’RNA ha una vita più breve rispetto al DNA e ‒ con alcune eccezioni ‒ non è responsabile della conservazione a lungo termine delle informazioni genetiche. Perciò le molecole di citosina, che spontaneamente si trasformano in uracili nell’RNA, non rappresentano una grande minaccia per la cellula. Di conseguenza, probabilmente non c’è stata una pressione evoluzionistica per sostituire, nell’RNA, l’uracile con la timina che è più complessa (e probabilmente più dispendiosa).
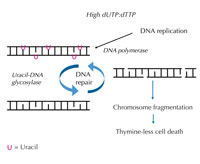
aumenta, il DNA polimerasi
incorpora frequentemente
l’uracile invece della timina,
sia durante la duplicazione
che durante la riparazione.
L’uracil-DNA glicosilasi
rimuove l’uracile e inizia
un’ulteriore riparazione
provocando la rottura dei
filamenti di DNA ad un livello
intermedio. Comunque, la
sintesi di riparazione
potrebbe reintrodurre
l’uracile causando un inutile
ciclo di riparazione del DNA.
Alla fine il sistema è
sovraccaricato e si verifica la
frammentazione dei
cromosomi causando la
morte cellulare. Cliccare
sull’immagine per ingrandirla
Immagine gentilmente
concessa da Angéla Békési
Morte cellulare per mancanza di timina
Quando il DNA è sintetizzato, i polimerasi del DNA (che catalizzano la sintesi) non riescono a distinguere la timina dall’uracile. Verificano soltanto se i legami ad idrogeni sono corretti, ossia se le coppie di basi sono combinate in modo corretto. A questi enzimi non interessa se è la timina o l’uracile ad unirsi all’adenina. Di regola, la quantità di deossiuridina 5′-trifosfato (dUTP, una fonte per l’uracile) nella cellula è molto bassa se paragonata ai livelli di desossitimidintrifosfato (dTTP, una fonte della timina) che impedisce l’incorporazione dell’uracile durante la sintesi del DNA.
Se questo rigido ordine viene perturbato e cresce la proporzione tra dUTP e dTTP, di conseguenza cresce la quantità di uracile che per errore è incorporato nel DNA. Il sistema di riparazione ‒ che, a differenza dei polimerasi del DNA, riesce a distinguere l’uracile dalla timina ‒ tenta quindi di eliminare l’uracile con l’aiuto dell’uracil-DNA glicosilasi e di risintetizzare il DNA, che temporaneamente rompe (elimina) la spina dorsale del DNA. Comunque, se la proporzione tra dUTP e dTTP è ancora elevata, questa risintetizzazione potrebbe di nuovo incorporare l’uracile invece della timina. Questo ciclo potrebbe causare la rottura dei filamenti di DNA e la frammentazione dei cromosomi, se queste eliminazioni temporanee nel DNA avvengono in successione e sono troppo vicine le une alle altre (v. figura 7). Ciò ha come risultato un determinato tipo di morte cellulare programmato, detto morte per mancanza di timina.
Il processo della morte cellulare per mancanza di timina può essere sfruttato, con le dovute cautele, nella cura del cancro. Poiché le cellule cancerogeni si moltiplicano più velocemente rispetto alle cellule normali, riescono a sintetizzare una quantità maggiore di DNA in un determinato lasso di tempo e pertanto richiedono quantità maggiori di dUTP. Aumentando la proporzione tra dUTP e dTTP, queste cellule cancerogene possono essere selezionate ed eliminate.
L’uracile nel DNA esiste ancora
Nonostante la maggior parte delle cellule usi l’uracile per l’RNA e la timina per il DNA, esistono delle eccezioni. Alcuni organismi presentano nel loro DNA l’uracile invece della timina. Altri organismi contengono l’uracile soltanto in una parte del loro DNA. Che vantaggio potrebbe derivarne? Guardiamo alcuni esempi.
L’uracile nel DNA virale
un virus batteriofago che
infetta una cellula batterica
Immagine gentilmente
concessa da cdascher /
iStockphoto
È noto che due specie di batteriofagi (virus che infettano i batteri) possiedono i genomi del DNA con soltanto l’uracile e senza la timina. Al momento non sappiamo ancora se questi batteriofagi rappresentino una forma di vita ancestrale che non ha mai sviluppato la timina nel DNA, o se i loro genomi sostituiti con l’uracile siano una strategia sviluppatasi di recente. Non sappiamo neanche perché questi batteriofagi usino l’uracile invece della timina, ma potrebbe giocare un ruolo sostanziale nel ciclo vitale di questi virus. Se le cose stanno così, allora avrebbe senso per i virus far sì che l’uracile nel loro DNA non venga sostituito dalla timina. Infatti è stato dimostrato che uno di questi batteriofagi presenta un gene che decodifica una proteina specifica che impedisce l’uracil-DNA glicosilasi dell’ospite. In tal modo si evita che l’uracile del genoma virale venga “riparato” dagli enzimi ospiti.
Morte cellulare programmata nei cicli vitali degli insetti

esempio le formiche, non
presentano l’enzima capace
di rimuovere l’uracile dal loro
DNA
Immagine gentilmente
concessa da spxChrome /
iStockphoto and Nicola Graf
Sembra anche che l’uracile nel DNA giochi un ruolo importante nello sviluppo degli oligoneoptera ‒ insetti che sono sottoposti al processo della pupa durante il loro ciclo vitale (formiche e farfalle attraversano questo stadio; cavallette e termiti no). A questi insetti manca il gene principale per l’uracil-DNA glicosilasi che altrimenti rimuoverebbe l’uracile dal DNA.
Inoltre, la nostra ricerca ha dimostrato che nelle larve del moscerino della frutta, il Drosophila melanogaster, la proporzione tra dUTP e dTTP è regolata in modo inusuale: in tutti i tessuti che non sono necessari nell’insetto adulto si trovano livelli più bassi dell’enzima che rompe il dUTP e genera un precursore per la produzione di dTTP. Di conseguenza, durante la sintesi del DNA, in questi tessuti vengono incorporate quantità significative di uracile.
In tal modo, durante lo stadio larvale viene prodotto uracile nel DNA e sembra che non venga corretto in quei tessuti che devono essere degradati durante lo stadio pupale. Poiché negli insetti non è presente l’enzima principale uracil-DNA glicosilasi, allo stadio pupale fattori addizionali specifici dell’uracile nel DNA potrebbero vedere in questo uracile accumulato un segnale per avviare la morte cellulare. Abbiamo già identificato una proteina specifica degli insetti che sembri essere capace di distruggere l’uracile nel DNA, e stiamo cercando di capire se questo enzima è usato per avviare la morte cellulare programmata.
Errori benefici: il sistema immunitario vertebrato

sequenze dei geni degli
anticorpi induce una risposta
di riparazione del DNA che
aumenta la diversità delle
proteine degli anticorpi. Un
pool esteso di anticorpi
aumenta il cambiamento del
sistema immunitario
riconoscendo gli invasori
indesiderati
Immagine gentilmente
concessa da taramol /
iStockphoto
Comunque, l’uracile nel DNA può trovarsi anche più vicino ‒ ossia nel sistema immunitario dei vertebrati simili a noi. Parte del nostro sistema immunitario, il sistema immunitario adattativo, produce un ampio numero di anticorpi diversi che sono allenati per proteggerci da agenti patogeni specifici. Per aumentare il numero dei diversi anticorpi che possono essere generati, riarrangiamo la sequenza di DNA nelle regioni che codificano per essi, non solo ricombinando le sequenze esistenti nelle cellule ma anche creandone di nuove attraverso tassi di mutazione elevati, noti come ipermutazione.
L’ipermutazione inizia con un’enzima specifico (un’attivazione indotta dalla deaminasi) che trasforma la citosina in uracile (v. figura 4) in un determinato locus del DNA. Ciò provoca una risposta di riparazione prodotta dall’errore, che l’organismo usa a suo vantaggio: gli “errori” generano nuove sequenze che possono essere usate per creare anticorpi diversi. Comunque, questo sistema è regolamentato in modo molto rigido perché, qualora se ne dovesse perdere il controllo, potrebbe causare il cancro.
Quando analizziamo la questione perché uracile o perché timina, dobbiamo considerare anche il contesto evoluzionistico. Gli organismi viventi si sono evoluti in un ambiente costantemente soggetto al cambiamento, affrontando sempre una serie di sfide. Quindi, una soluzione che fa si che gli errori non vengano incorporati nel DNA è un vantaggio per la maggior parte degli organismi e delle cellule, e tale soluzione spiega perché la timina nel DNA è diventata la norma. Sotto certi aspetti, comunque, gli “errori” stessi possono essere benefici. Questo è il motivo per cui alcune cellule ancora usano l’uracile nel loro DNA.
Resources
- Per conoscere più approfonditamente il lavoro del gruppo di ricerca di Beáta Vértessy, v.: www.enzim.hu/~vertessy
- Per scaricare un riassunto della tesi di PhD di Villő Muha, che è stata scritta sotto la supervisione di Beáta Vértessy e che si focalizza sull’uracile nel DNA nei Drosophila melanogaster, utilizzare il link: http://teo.elte.hu/minosites/tezis2010_angol/v_muha.pdf
-
La tesi completa è disponibile al seguente indirizzo: http://teo.elte.hu/minosites/ertekezes2010/muha_v.pdf
-
Review
Questo articolo dimostra che la scienza non riposa mai, sconvolgendo il dogma che l’uracile si trovi solo nell’RNA. Ma come spiega l’articolo, non è sempre così. Ed anche se lo fosse, perché dovrebbe essere così?
Per aiutare gli studenti a capire l’articolo, ci si può avvalere delle seguenti domande:
- Descrivete le strutture che legano le due coppie di basi complementari nel DNA.
- Quale di queste basi cambia nell’RNA?
- Descrivete e disegnate un grafico del meccanismo enzimatico di riparazione attivato quando viene rinvenuto uracile nel DNA.
- Il rapporto proporzionale tra quali molecole potrebbe essere aggiustato per impedire che le cellule cancerogeni crescano e si moltiplichino?
- Perché l’uracile è “tollerato” nell’RNA?
- Quali organismi viventi usano l’uracile nel DNA e in che modo?
Friedlinde Krotscheck, Austria





