Renk, klorofil ve kromatografi Teach article
Fotosenteze katkısı olan ve yapraklara renklerini veren pigment çeşitliliğini keşfetmek için ince tabaka kromatografisi kullanılır.

Yemyeşil bir vadiye veya ormana bakarken, farklı tonların yelpazesini görmek büyüleyicidir. Yapraklar açık, koyu ve hatta benekli olarak değişir. Renkler, çoğu canlı organizmalardaki en önemli metabolik reaksiyonlardan biri olan fotosentezden sorumlu olan farklı pigmentlerin sayesinde oluşur.
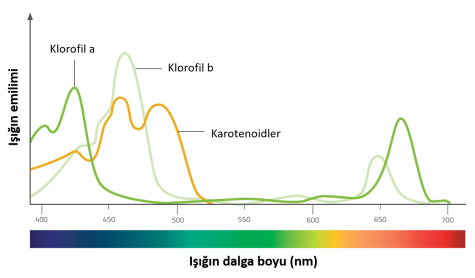
Fotosentez yapan pigmentler yaprağın kloroplastlarında bulunur. Kloroplastlar, karbonhidratları inorganik maddeden sentezlemek için kullandıkları ışık spektrumundan enerjiyi yakalarlar. Farklı fotosentetik pigment türleri vardır, ancak iki ana grup klorofiller ve karotenoidlerdir (bunlar ayrıca iki sınıfa ayrılır: karotenler ve ksantofiller). Her tip farklı bir dalga boyunu emer, böylece birlikte daha fazla ışık yakalarlar.
Klorofiller fotosentezden sorumlu esas pigmentlerdir. Kırmızı ve mavi ışığı emerken yeşil ışığı yansıtırlar, böylece yapraklar yeşil görünür. Karotenoidler ise sonbaharda yapraklara sarı, turuncu ve kırmızı renk verir. Yılın bu zamanında klorofil parçalanır, böylece karotenoid pigmentler görünür hale gelir.
Karotenoidler, klorofillerin absorbe edemediği ışığın dalga boylarını emerek fotosenteze katkı sağlarlar. Enerjiyi, klorofil moleküllerine aktarırlar ve ayrıca yaprağın fazla ışıktan korunmasına yardımcı olurlar (bunlar fazla ışığı emer ve yaprağa zarar görmemesi için ışığı ısı olarak dağıtırlar).
Antosiyaninler veya diğer flavonoidler gibi fotosentetik olmayan diğer pigmentler çiçeklerin rengini belirler, dolayısıyla absorpsiyon spektrumları farklıdır. Bu pigmentlerin işlevi, tozlaşma için böcekleri veya kuşları cezbetmektir.
Nicola Graf
İnce tabaka kromatografisi kullanılarak yaprak pigmentlerinin ayrılması
Bu makale yaprak pigmentlerini anlamak için basit bir laboratuvar deneyi sunmaktadır. Öğrenciler, iki farklı yaprak ekstraktında bulunan çeşitli pigmentleri ayırmak için ince tabaka kromatografisini kullanırlar. Öğrenciler her pigmenti tanımlar ve iki ekstraktın ortak pigmentlere sahip olup olmadığını belirlerler. Deney 11-16 yaş arası öğrenciler için uygundur ve tamamlanması 1-2 saat sürer.
Epipremnum aureum (yaygın olarak şeytanın sarmaşığı olarak bilinir) ve Ficus benjamina‘dan (yaygın olarak ağlayan incir olarak bilinir) yapraklar kullandığımızı, ancak yaprak özütleri için herhangi bir türün kullanılabileceğini unutmayın. Deneyi Petunya cinsindekiler gibi parlak renkli bir çiçek ve ayrıca sarı veya turuncu bir yaprak kullanarak da yapabilirsiniz

Joydeep/Wikimedia Commons, CC BY-SA 3.0

JM Garg/Wikimedia Commons, CC BY 3.0
İnce tabaka kromatografisi için, en iyi ayırmayı sağladığı için hekzan, aseton ve triklorometandan oluşan kombine bir mobil faz kullanırız. Ancak, etkinliğin bir kısmının öğretmen tarafından çeker ocak içinde yürütülmesi gerekir. Bu hareketli faz, pigmentleri en iyi şekilde ayırır, ancak aktiviteyi öğrencilerin gerçekleştirebilecekleri sadece hekzan veya etanolün hareketli fazlarını kullanacak şekilde ayarlayabilirsiniz. Hem hekzan hem de etanol, pigmentleri net bir şekilde ayırır, ancak her pigment arasındaki ayrım, kombine çözücü kullanımı kadar net değildir.
Malzemeler
- Yaprak örnekleri ( aureum ve F. benjamina), yaklaşık 2 cm x 2 cm ölçülerinde parçalar kesilir.
- Silika jel ile ince tabaka halinde önceden kaplanmış kromatografi plakaları (10 cm x 5 cm)
- Organik çözücü şunları içerir:
- 3 kısım hekzan, C6H14
- 1 kısım aseton, (CH3)2CO
- 1 kısım triklorometan, CHCl3
- Bir beher ve saat camı (veya kromatografi küveti)
- Belirleme karosu (bir reaksiyon karışımında renk değişikliklerini gözlemlemek için kullanılan gözlemsel ekipman parçası)
- Havan
- 1 ml’lik Pasteur pipetleri (her yaprak örneği için bir adet)
- Kalem
Güvenlik notu
Laboratuvar önlüğü, eldiven ve gözlük takılmalıdır. Kullanılan çözücüler yanıcıdır, bu nedenle alevlerin yakınında kullanılmamalıdır. Kombine çözücü (hekzan, aseton ve triklorometan), uçuculuk, koku ve sağlık riskleri nedeniyle sadece bir davlumbazın (çeker ocak) içinde kullanılmalıdır.
Yöntem
Aşağıdaki adımlar öğrenciler tarafından gerçekleştirilmelidir:
- İlk yaprak örneğinizi havana yerleştirin. Havan içine 1 ml aseton ekleyin ve yaprak parçalanana kadar havan tokmağı ile ezin.
- Karışımı pipet kullanarak belirleme karosunun bir kuyusuna aktarın.
- Havanı ve havan tokmağını yıkayın ve ikinci yaprak örneğini kullanarak 1. ve 2. adımları tekrarlayın. 1 ml aseton eklemek için yeni bir pipet kullanın ve karışımı belirleme karosunun yeni bir kuyusuna aktarın.
- Kromatografi plakasını alın ve bir kalem kullanarak alttan 1.5 cm yatay bir çizgi çizin. Plakaya parmaklarınızla dokunmamaya dikkat edin.
- İlk pipetinizi kullanarak (her yaprak örneği için hangi pipetlerin kullanıldığını karıştırmamaya dikkat edin), ilk yaprak numunenizin bir miktarını pipetleyin. Kromatografi plakasının kalemle çizdiğiniz çizgisinde sol tarafa tek, küçük bir damla olacak şekilde damlatın. İkinci numuneyi onun sağ tarafına sığdırmak için yeterli alan bıraktığınızdan emin olun.
- Kuruyana kadar bekleyin ve aynı noktalara aynı numunelerden ikinci bir damla ekleyin. Yaklaşık 10 damla ekleyene kadar böyle devam edin.
- İkinci pipetinizi kullanarak, ikinci yaprak örneği için 5. ve 6. adımları tekrarlayarak plakanın sağ tarafını kullanın.
- Plakanın tamamen kurumasını bekleyin.
Aşağıdaki adımlar öğretmen tarafından gerçekleştirilmelidir:
- Çeker ocak içinde, çözücüleri aşağıdaki oranlarda birleştirin: hekzan, aseton ve triklorometan, 3:1:1.
- Kombine çözücüyü behere ekleyin. Plakayı, kromatografi plakasındaki kalemle işaretlenmiş çizgi suya batmayacak şekilde çözücüyle sığ bir şekilde doldurun.
- Kromatografi plakasını, alttaki kalem çizgisi aşağıda olacak şekilde ancak çözücüye değmeyecek şekilde behere dikey olarak yerleştirin ve beheri bir camı ile örtün. Öğrenciler çözücünün plaka üzerinde nasıl hareket ettiğini ve pigmentlerin nasıl ayrıldığını izleyebilirler.
- Plakayı beherden çıkarmadan ve çeker ocağın içine bırakmadan önce çözücünün başlangıç noktasından yaklaşık 6 cm uzaklaşmasını bekleyin (bu yaklaşık 15-30 dakika sürecektir).
- Çözücünün ulaştığı en uzak noktayı hızlıca işaretlemek için bir kalem kullanın. Çeker ocaktan çıkarmadan önce plakanın tamamen kurumasını bekleyin.
Aşağıdaki adımlar öğrenciler tarafından gerçekleştirilebilir:
- Kromatogram kuruduktan hemen sonra fotoğrafını çekin çünkü renkler birkaç saat içinde kaybolur.
- Kromatogram fotoğrafını kullanarak, her yaprak ekstraktında kaç tane pigment olduğunu hesaplayın.
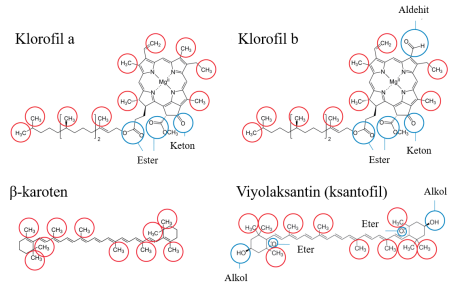
- Şimdi farklı pigmentlerin kimyasal yapılarına bakın (bakınız şekil 1). Hangi pigmentin hangisi olduğunu belirleyebilir misiniz (daha fazla yönlendirme için açıklama bölümüne bakın)? Cevaplarınızı yazın.
- Çözücü ve pigmentlerin yol aldığı mesafeleri ölçün ve aşağıdaki denklemi kullanarak alıkonma faktörünü (Rf) hesaplayın:
Rf = (pigmentle kat edilen mesafe) / (çözücü ile kat edilen mesafe)
Sonuçlarınızı bir tabloya geçirin. Bunları tablo 1’deki değerlerle karşılaştırın: cevaplarınızı kontrol edin.
Nicola Graf
Açıklama
Bir yaprak ekstraktındaki farklı pigmentler, sabit faz (polar olmayan bir madde olan ince tabaka kromatografi plakasındaki silika) ve mobil faz (polar olmayan bir çözücü) için afinitelerine göre ayrılır. Çözücü için yüksek afiniteye sahip bileşikler (yani polar olmayan bileşikler), silika için yüksek afiniteye sahip bileşiklerden (yani polar bileşiklerden) çok daha fazla hareket edecektir.
Örneğimizde (şekil 2), her iki yaprak ekstresi de dört pigment içeriyordu. Pigment 4, pigment 1’den daha kısa bir mesafe kat etti, bu da pigment 4’ün daha polar ve pigment 1’in daha az polar olduğunu gösteriyor. Farklı pigmentlerin kimyasal yapılarına ve polar ve polar olmayan gruplara bakarak, öğrenciler yaprak özütlerinin her birindeki pigmentleri tanımlamaya çalışabilirler.
Şekil 1’deki pigmentlerde bulunan fonksiyonel gruplardan alkol gruplarının polar, ester ve eter gruplarının en az polar, aldehit ve keton gruplarının ise arada bir yerde olduğunu bilmeleri gerekecektir. Bundan, karotenlerin en az polar pigment (polar grup yok) ve ksantofillerin daha polar (molekülün her iki ucunda bir tane olmak üzere iki alkol grubu) olduğu sonucuna varabiliriz. Bu nedenle, pigment 1 ve 2’nin karoten olması ve pigment 4’ün bir ksantofil olması muhtemeldir. Pigment 3’ün klorofil olması muhtemeldir, çünkü karotenlerden daha polardır, ancak ksantofillerden daha az polardır. Kromatogramda, klorofilden kaynaklanan yeşil rengi gözlemleyebilirsiniz.

Josep Tarragó-Celada
Şimdi 0 ile 1 arasında değişen Rf değerlerine bakın, 0 hiç hareket etmeyen bir pigmenttir ve 1 çözücü ile aynı mesafeye hareket eden bir pigmenti gösterir. Rf değeri, kullanılan çözücüye bağlı olarak değişir, ancak pigmentlerin genel sırası (en yüksekten en düşük Rf değerine göre) genellikle değişmez, çünkü polar olmayan bileşikler polar bileşiklerden daha fazla hareketlidir. Çeşitli pigmentler için Rf değerleri (çözücü için heksan, aseton ve triklorometan (3:1:1)) tablo 1’de gösterilmiştir.
| Pigment | Rf değeri |
|---|---|
| β-karoten | 0.98 |
| Klorofil a | 0.59 |
| Klorofil b | 0.42 |
| Antosiyaninler | 0.32-0.62 |
| Ksantofiller | 0.15-0.35 |
Tartışma
Deneyden sonra, öğrencilerinize bitki pigmentleri ve ince tabaka kromatografisi hakkındaki bilgilerini ölçmek için aşağıdaki sorulardan bazılarını sorabilirsiniz.
- Çeşitli bitki pigmentleri için absorpsiyon spektrumlarına bakınız. En fazla kırmızı ışığı emen hangi pigment oldu? Renkleri nedir?
- Klorofil en önemli fotosentetik pigment ise, görünür spektrumun hangi renkleri fotosentez için en yararlısıdır?
- Deniz yosunları genellikle sarı-kahverengi renktedir. Spektrumun kırmızı ucundan veya mavi ucundan gelen ışığın suya en iyi şekilde nüfuz ettiğini düşünüyor musunuz?
- Hangi bitkilerin yeşilden farklı yaprakları vardır? İçerdikleri pigmentleri nasıl bulabilirsiniz?
- Yaprağın içinde fotosentetik pigmentler nerede bulunur?
- Bitkilerin farklı fotosentetik pigment içermeleri neden yararlıdır?
- İnce tabaka kromatografisi kullanarak bitki pigmentlerini araştırmak için polar olmayan bir çözücü (hekzan, aseton ve triklorometan gibi) kullanmak ve polar olmayan bir çözücü (su gibi) kullanmak neden önemlidir?
- Neden ince tabakalı kromatografi plakasına dokunmaktan kaçınmalısınız?
- Plakayı behere koymadan önce neden tamamen kuru olmalıdır?
- Neden bazı pigmentler diğerlerinden daha büyük bir Rf değerine sahiptir?
References
- Reiss C (1994) Experiments in Plant Physiology. Englewood Cliffs, NJ, USA: Prentice Hall. ISBN: 0137012853
Resources
- Yaprakların renginin arkasındaki kimyasalları açıklayan bir infografik için Compound Interest web sitesini ziyaret edin.
- Harvard Üniversitesi’nden Harvard Forest web sitesini ziyaret ederek farklı bitki pigmentlerinin kimyasal yapısı hakkında daha fazla bilgi edinin.
Review
Doğanın dış unsurunu farklı kimyasal yapıların tanımlanmasıyla birleştirmek, mükemmel bir uygulamalı fen dersi üretir. Yapraklardaki farklı pigmentlerin analizi, daha sonra farklı fotosentetik pigmentlerin kimyasal yapılarıyla ilişkilendirilebilecek net bir görsel sonuca sahiptir.
Bu pratik etkinlik, öğrencilere temel kağıt kromatografisinin ötesine, daha karmaşık ince tabaka kromatografi tekniğine geçme fırsatı veriyor. Bu müfredatlar arası görev, fotosentez gibi biyoloji temelli konulardan hoşlanan öğrencilerin yanı sıra kimyadaki analitik tekniklerin problem çözme yönünden hoşlanan öğrencileri de ilgilendirecektir.
Etkinlik, bir bilim kulübü veya yaz etkinliğinin bir parçası olarak 14-16 yaş arası öğrenciler için uygundur. Ana yönteme ek olarak, yazarlar, öğrencilerin deneyi tamamen bağımsız olarak gerçekleştirebilmeleri için farklı çözücüler kullanma önerileri sunmaktadır. Daha ayrıntılı olarak, etkinlik 16-19 yaş arası öğrenciler için de yararlı olabilir.
Birçok yeni terim tanıtılmıştır, bu nedenle makale öğrencilere mobil ve durağan fazlar, moleküllerin polaritesi ve biyolojinin temel olarak kimyasal yapı taşlarına nasıl dayandığı gibi kavramları anlamalarına konusundaki yaşadıkları zorluklar için mükemmel bir şans sunmaktadır.
Caroline Evans, kimya bölümü başkanı, Wellington College, Birleşik Krallık





