Brže, jeftinije, CRISPR: nova revolucija genske tehnologije Understand article
Prevela Nina Portolan (Biološki fakultet Univerziteta u Beogradu). Kontroverzna nova tehnologija čini editovanje gena mnogo jeftinijim i lakšim – možda previše lakim?

slike: Nicola Graf
Kucate rečenicu i shvatate da je jedno slovo pogrešno otkucano. Ova greška će promeniti značenje rečenice, pa zato postavljate kursor kod pogrešnog slova, pritiskate backspace i unosite ispravno slovo. Ovo je izuzetno lak zadatak. Neverovatno je, ali ovaj jednostavan pristup se sada imitira u laboratorijama, gde su naučnici u ulozi autora i DNK u ulozi poruke biva modifikovana.
Ovo je realnost koju nudi CRISPR-Cas9, nova tehnologija koja je uzburkala naučnu zajednicu u proteklih nekoliko godina. Pored toga što obećava važne napretke iz oblasti biomedicine, sada donosi i velike probleme. Zaista, interesovanje medija i medijska pokrivenost o ovoj kontroverznoj tehnici su već toliko veliki da bi se nastavnici uskoro mogli naći pred pitanjima učenika o CRISPR- Cas9. Ovde vam nudimo kratak vodič o tome šta je CRISPR-Cas9 i zašto je važan.
Šta je CRISPR–Cas9?
CRISPR-Cas9 je sistem koji bakterije koriste da se odbrane od napada virusa, ali je od nedavno eksploatisan kao tehnologija za sečenje genoma na tačno određenim mestima. Sistem čine dve komponente: CRISPR i Cas9. CRISPR je skraćenica za ‘clustered regularly interspaced short palindromic repeats’ odnosno “grupisani kratki palindromski ponovci na jednakim rastojanjima”, i odnosi se na mesta u genomu gde se DNK sekvenca ponavlja. U blizini ovih ponovaka nalaze se Cas geni koji kodiraju važne enzime u živom sistemu. Jedan od njih, Cas9, je nukleaza –odnosno, enzim koji seče nukleinske kiseline (DNK ili RNK).
Kada virus napadne bakteriju, on unosi svoju nukleinsku kiselinu u bakteriju, koja kao odgovor na to proizvodi Cas enzime da iseku delove virusne nukleinske kiseline i inkorporišu je u svoj genom na CRISPR mestima (slika 1). Ovo bakteriji daje koristan stečeni imunitet: sledeći put kada ista vrsta virusa napadne, CRISPR mesta, zajedno sa virusnom nukleinskom kiselinom, transkribuju se u RNK molekule. Ovi kratki RNK molekuli se vezuju za Cas9 enzim i potom rezultujući kompleks dovode do nukleinske kiseline napadača, koju identifikuju preko poklapanja sekvence. Cas9 tada seče ciljnu nukleinsku kiselinu, onemogućujući time da virus iskoristi bakteriju za sopstvenu replikaciju.
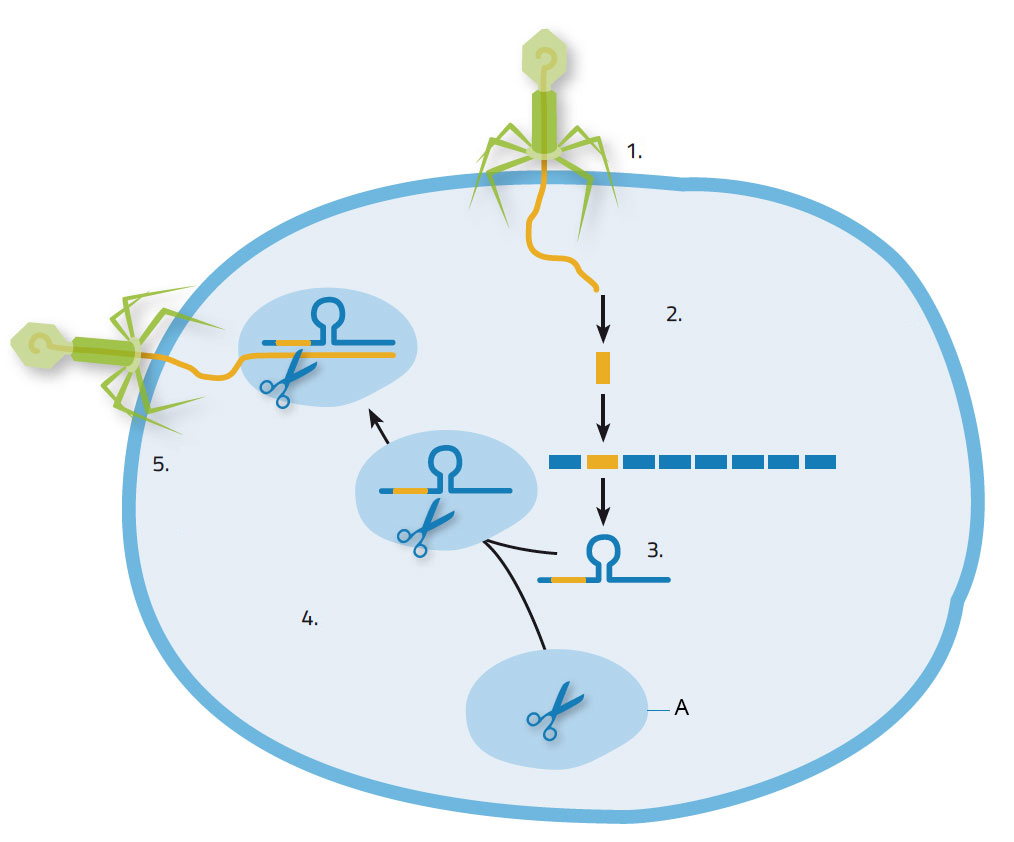
1.Virus napada bakterijsku ćeliju; 2. Nukleinska kiselina iz virusa biva ugrađena u nukleinsku kiselinu bakterije na CRISPR mestu; 3. Formira se CRISPR RNK; 4. CRISPR RNK se vezuje za Cas9 enzim; 5. CRISPR RNK odvodi Cas9 enzim do virusa. On seče i uništava virusni genom.
Odobrenje za objavljivanje slike: Nicola Graf
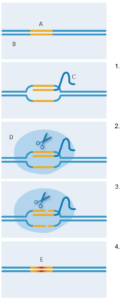
pomoću CRISPR-Cas9.
A: Ciljna sekvenca; B: DNK; C:
vodeća RNK; D: Cas9; E: Nova
DNK sekvenca
1.Vodeća RNK se vezuje za
ciljnu DNK sekvencu; 2. Cas9
enzim se vezuje za vodeću
RNK; 3. Cas9 seče oba lanca
DNK; 4. Bakterijski sistem za
popravku DNK uvodi novu
sekvencu na mesto prekida
lanaca, zamenjujući
originalnu sekvencu DNK.
Slika dobijena od: Nicola Graf
Kako je ovaj bakterijski sistem adaptiran da obezbedi novu genetičku tehnologiju? Tokom 2012. godine timovi Jennifer Doudna sa Berkli Univeriteta u Kaliforniji, SAD (University of California Berkeley, USA), i Emmanuelle Charpentier, tada sa Umea Univerziteta u Švedskoj (Sweden’s Umea University) modifikovali su i spojili kratke RNK molekule u jedan molekul, ‘vodeću’ RNK (slika 2). Zadržali su jedan kraj koji može da se veže za Cas9, ali da sekvence sa drugog kraja mogu da se sparuju sa bilo kojom poznatom ciljnom DNK. Sa ovom mogućnošću za prilagođavanje CRISPR-Cas9 mogao je specifično da iseca DNK sekvence po izboru. Nedugo zatim, Feng Zhang-ova laboratorija na Tehnološkom Institutu u Masačusetsu, SAD (Massachusetts Institute of Technology, USA) dodatno je unapredila CRISPR-Cas9, pokazujući njegovu sposobnost da precizno indukuje prekide u genomu ćelija čoveka i miša (Cong et al, 2013). Pored toga, prepravili su Cas9, tako da seće DNK na malo drugačiji način, i time stimuliše specifičan mehanizam reparacije oštećenja DNK u ćelijama. To znači da su naučnici uspešno ubacili novu DNK na mesto isečene, zamenjujući originalnu sekvencu. (slika 2).
Uz ove pionirske napore, CRISPR-Cas9 je transformisan od specifične teme u mikrobiologiji do uzbudljivog alata za istraživanje koji naučnicima omogućava da edituju gene u različite svrhe sa velikom preciznošću i lakoćom.
Za šta se koristi?
Da bi proučili funkciju gena, naučnici se ćesto trude da proizvedu ćelijske linije ili model organizme u kojima je gen od interesa mutiran ili inaktiviran (tehnika poznata pod imenom knockout gena). CRISPR-Cas9 pruža brz i precizan način da ovo urade. Pored toga, Cas9 enzim može biti modifikovan tako da izgubi mogućnost da seče DNK, ali da još uvek može da se veže za specifične DNK sekvence, zahvaljujuči vodećoj RNK. Ovo ima efekat fizičkog blokiranja vezivanja RNK polimeraze, što omogućava naučnicima da kontrolišu transkripciju gena – početnu tačku genske aktivnosti.
Mada su ovo važne tehnike u biomedicinskim istraživanjima, CRISPR-Cas9 takođe obećava direktniju primenu u zdravstvu. Naučnici su već upotrebili CRISPR–Cas9 editovanje gena da iseku HIV sekvence i spreče virus da se umnožava u ćelijskim linijama čoveka. Takođe je već korišćen da se ukloni mutirana sekvenca kod miševa sa Dišenovom (Duchenne) mišičnom distrofijom koja uzrokuje slabost mišića, tako da tehnika predstavlja nadu za terapiju porodicama obolelim od ove i sličnih genetskih bolesti. Nedavno, embrioni svinje su podvrgnuti velikim genetskim izmenama uz pomoć CRISPR-Cas9 u nadi da će biti bezbedniji izvor organa za transplantaciju kod ljudi.
Ako je editovanje već urađeno sa embrionima svinje, da li bi moglo da se izvrši i na ljudskim embrionima? Ovo je upravo ono što su kineski istraživači uradili 2015., kada su upotrebili CRISPR-Cas9 da izmene β-thalassaemia gen kod 85 ljudskih embriona (Cyranoski & Reardon, 2015). Tehnika se ispostavila prilično neefikasnom, obzirom da je DNK sekvenca uspešno izmenjena kod manje od četvrtine embriona. Bez obzira na to, objavljivanje ovog pronalaska izazvalo je mnogo kontroverze zbog svojih etičkih implikacija.
Etički problemi – i budućnost
Etičke nedoumice odnose se ne samo na eksperimente na ljudskim embrionima, već i pomalo uznemirujuću mogućnost inžinjeringa germinativnih stem ćelija. Sa CRISPR-Cas9, teorijski je moguće uneti izmene u genom germinativnih ćelija (spermatozoidi i jajne ćelije), koje bi mogle da se prenesu na naredne generacije. Osim što ova ideja ima veliki potencijal da iskoreni genetske bolesti, ona takođe postavlja pitanje koje modifikacije bi trebalo da budu dozvoljene kao medicinski tretman u budućnosti. Da li bi osobine poput inteligencije ili boje očiju mogle da se smatraju adekvatnim za medicinsko unapređivanje? Ovo strahovi možda izgledaju daleki, ali postoji još jedan razlog za brigu: inžinjering germinativnih stem ćelija mogao bi da ima potpuno nepredviđene i nepovratne posledice po buduće generacije. Ovo je naročito važno obzirom da su nedavna genetička istraživanja pokazala da su interakcije između gena i drugih mehanizama nasleđivanja mnogo složenije nego što se ranije mislilo.
Ove implikacije nisu promakle naučnicima. Neki se slažu da je inžinjering germinativnih stem ćelija prepun etičkih “nagaznih mina” i veruju da svako CRISPR-Cas9 istraživanje koje koristi humane embrione treba obustaviti. Drugi, međutim, veruju da moratorijum ne bi bilo teško sprovesti, ali da bi to takođe ometalo napredak istraživanja. Uprkos tako različitim gledištima, naučna zajednica se naizgled odlučila za dijalog i transparentnost kao najbolji put napred, što dokazuju brojni samiti i sastanci na ovu temu širom sveta.
U međuvremenu, razvoj CRISPR-Cas9 nastavlja se velikom brzinom. Farmaceutske kompanije istražuju ovu tehnologiju da bi unapredile razvoj i istraživanje lekova, a tehničke mane se popravljaju i unapređuju – dok se između pionira tehnike (Doudna/Charpentier i Zhang) vodi ogorčena sudska rasprava oko patenta. Bez obzira na njen ishod, meteorski uspon CRISPR–Cas9 je samo početak.
References
- Cong L et al. (2013) Multiplex genome engineering using CRISPR/Cas systems. Science 339: 819–23. doi: 10.1126/science.123
- Cyranoski D, Reardon S (2015) Chinese scientists genetically modify human embryos. Nature 22 April, doi:10.1038/nature.2015.17378
Resources
- Pročitajte više o potencijalnoj upotrebi CRISPR u editovanju gena RNK.
- Pročitajte više o sporu za patent koji se vodi oko CRISPR-Cas9 tehnologije.
- Naučite kako se CRISPR-Cas9 tehnologija koristi u tretmanu Dišenove (Duchenne) mišićne distrofije.
- Pročitajte o tome kako se CRISPR-Cas9 koristi za proizvodnju organa za ljudsku transplantaciju, u svinjama.
- Pročitajte pristupačan članak o etičkim problemima pri editovanju gena u germinativnim ćelijama.
- Za članak koji sadrži komentare internacionalnih genetičara na temu etičkih problema pri editovanju gena u germinativnim ćelijama, pogledajte:
- Bosley K et al. (2015) CRISPR germline engineering – the community speaks. Nature Biotechnology 33: 478–86
- Pročitajte više o revolucionarnoj tehnici editovanja gena Emmanuelle Charpentier, i slušajte kako govori o svom radu.
Review
CRISPR-Cas9 je moćno oruđe za editovanje gena nalik GPS-u. Ima potencijal da otvori vrata ka širokoj primeni u nauci, medicini i agrikulturi. Realatvna jednostavnost i niska cena tehnike otvara važna etička pitanja. Takođe je dovela do sudske tužbe između naučnika po pitanju dragocenih prava na patent.
Članak jasno opisuje identifikaciju palindromskih ponovaka kao osnovnog odbrambenog mehanizma bakterija u svrhu primene kod programiranog editovanja gena uz pomoć CRISPR-Cas9. Ovaj članak se može koristiti da objasni, zajedno sa animacijama, molekularno biološke tehnike koje su u upotrebi i zašto je CRISPR-Cas9 zamenio ranije metode editovanja gena. Takođe može da posluži kao osnova za diskusiju o etičkim pitanjima vezanim za editovanje germinativnih linija i o intelektualnoj svojini. Pitanja za razumevanje članka mogu da uključiju:
- Šta znači skraćenica CRISPR?
- Kako funkcioniše CRISPR-Cas9?
- Koje vrste bolesti mogu da se leče pomoću CRISPR-Cas9?
- Koji su potencijalni rizici kod korišćenja CRISPR-Cas9?
- Koji su etički problemi vezani za upotrebu CRISPR-Cas9?
- Kome bi trebalo da bude dodeljena Nobelova Nagrada za otkriće CRISPR-Cas9?
Mary Brenan, Concord College, UK





