Combătând HIV cu neutronii Understand article
Tradus de Mircea Băduţ. Când ne gândim la cercetări cu ajutorul difracției, de obicei ne vin în minte razele X, însă şi neutronii ne pot oferi informații structurale importante – și ne-ar putea ajuta în lupta impotriva virusului imuno-deficienţei (HIV).
Când este vorba de cristalografie, tehnica ce ne vine imediat în minte este difracția cu raze X. Şi nu-i de mirare: în biologie, mai mult de 88 000 de structuri de proteine, acizi nucleici, viruși și ansambluri macromoleculare au fost determinate cu ajutorul razelor X. Dar, pe măsură ce cristalografia folosind neutroni se îmbunătățeşte, ea devine tot mai aplicabilă în proiectarea de medicamente. Cercetătorii de la Institutul Laue-Langevin (ILL) din Grenoble, Franța, au folosit recent facilităţile de laborator pentru a înțelege modul în care un medicament anti-retroviral ţinteşte împotriva HIV.

Mulţumiri pentru imagine – ILL
Încă din primele zile ale studierii proteinelor prin cristalografie cu raze X, acum aproximativ o sută de ani, tehnica a suportat dezvoltării dramatice și a devenit larg răspândită. Fascicule intense de raze X, furnizate de surse de radiații din familia sincrotronului, facilitează colectarea de date din cristale mici, de doar câţiva micrometri, în câteva secunde (vedeţi Cornuejols, 2009).
În contrast, dezvoltarea cristalografiei cu neutroni pentru molecule biologice mari s-a profilat mult mai puțin, iar aplicarea ei a fost mai puțin răspândită. Principalul motiv pentru aceasta derivă din faptul că numărul de particule pe centimetru pătrat pe secundă (adică ‘fluxul’), chiar provenind din cele mai intense surse de neutroni, este cu mult mai mic (cu câteva ordine de mărime) decât în cazul fluxurilor din surse de raze X.
Aceasta a însemnat, până de curând, că sunt necesare cristale mari şi timpi de expunere lungi pentru a folosi cristalografia neutronică la colectarea datelor. Însă optimizări recente au condus la posibilitatea de a colecta suficiente date folosind cristale mai mici şi în doar câteva zile. Timpul necesar colectării încă este mai mare decât în cazul experimentelor bazate pe raze X, așa că ne putem întreba „de ce să folosim totuşi neutronii?”. Iar unul dintre motive ne vine de la cel mai mic atomul din Univers: hidrogenul.
Importanţa hidrogenului
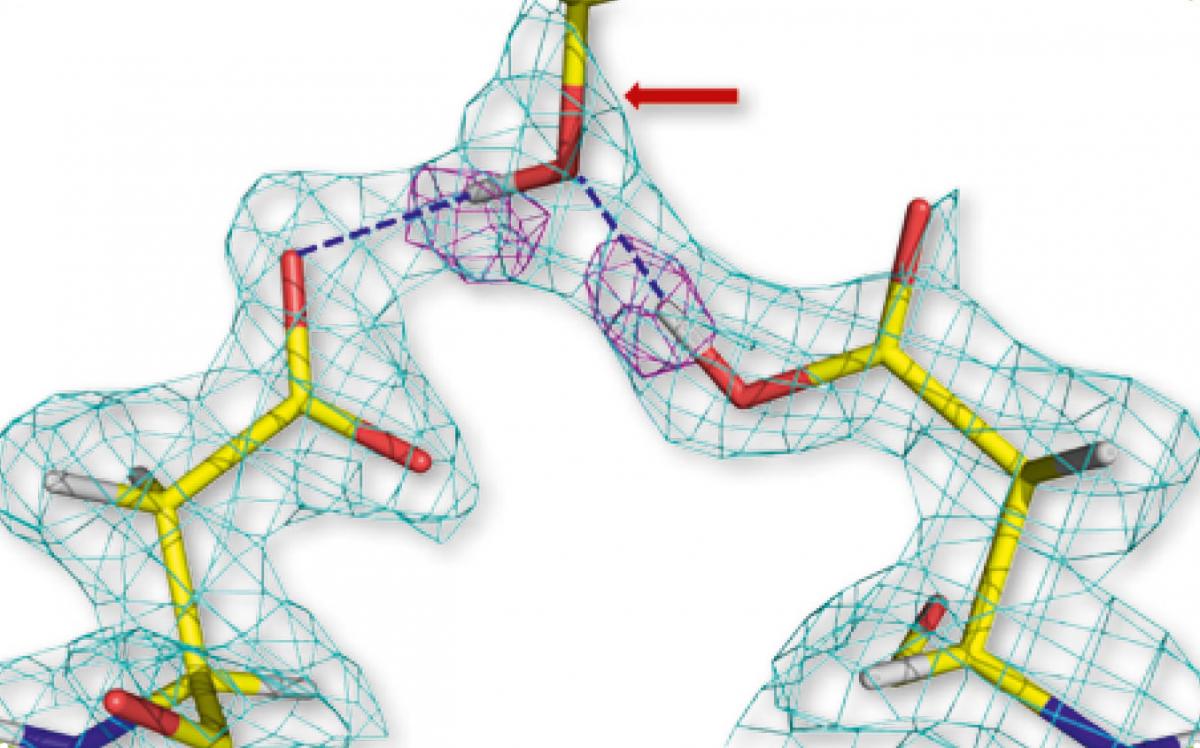
aspartic pentru două
molecule de protează HIV-1
(stânga și dreapta),
hidrogen-legat la gruparea
hidroxil a medicamentului
aprenavir (centru). Formele
geometrice roz reprezintă
atomi de hidrogen.
Mulţumiri pentru imagine –
Andrey Kovalevsky
Cele mai multe medicamente acţionează ‘lipindu-se’ de enzima specifică respectivei boli, şi astfel inhibându-i funcția. Multe dintre proiectările actuale de medicamente se concentrează pe analiza și pe optimizarea interacțiunilor dintre medicament și ținta sa. Cristalografia cu raze X a fost metoda favorită pentru a descifra asemenea detalii structurale, însă razele X în general nu dezvăluie poziția atomilor de hidrogen dintr-o moleculă. Ori, aceştia joacă deseori un rol crucial în legarea folosind importantele interacțiuni slabe cunoscute sub numele de ‘legături de hidrogen’.
În schimb neutronii pot localiza pozițiile tuturor atomilor, inclusiv hidrogenul, și astfel ei constituie un instrument analitic puternic pentru studierea interacțiunilor de legare la enzime ale medicamentelor., Aspectul a fost demonstrat recent într-un studiu privind legarea unui medicament antiretroviral HIV (amprenavirul) la enzima sa țintă, proteaza HIV-1. Această enzimă proteolitică este componentă esenţială a ciclului de viață HIV – ea descompune polipeptidele virale pentru a crea proteinele necesare la maturarea și la producerea de noi particule virale infectioase.
Cercetătorii au direcţionat un fascicul de neutroni spre un cristal mic de protează HIV-1 legată la amprenavir (având o dimensiune de numai 0,2 mm3) pentru a colecta date la o rezolutie de doar 0,2 nanometri. Aceste date au permis cercetătorilor să localizeze atomii de hidrogen în agregatul enzime-medicament – și, apect critic, să identifice acei atomi care participă la legarea hidrogenului între medicament și enzimă.
O rezoluţie mai fină
Folosind studiile anterioare cu raze X, oamenii de știință speculaseră că mai multe interacțiuni ale hidrogenului ar fi importante în legarea amprenavirului de proteaza HIV-1. Cu toate acestea, studiul cu neutroni a revelat faptul că există doar două legături puternice directe, prin hidrogen, între medicament și enzimă (figura 1). Constatarea deschide proiectanţilor de medicamente noi căi pentru a întări această legătură prin modificări subtile în structura moleculară a medicamentului. Iar aceste modificări vor crește eficiența medicamentului și vor reduce doza necesară tratamentului.
Spre exemplificare, proiectanţii de medicamente ar putea determina cele două legături de hidrogen să fie și mai puternice, prin adăugarea unui atom reactiv, de genul fluorului. Alternativ, ei pot adăuga mai multe legături directe de hidrogen, de exemplu prin încorporarea unor grupuri mai mari de atomi în structură, ceea ce va expulza molecule de apă găsite în locaţia complexului de legare medicament-enzimă.
Sensibilitatea unică a analizei cu neutroni la atomii de hidrogen furnizează industriei farmaceutice un instrument nou și puternic pentru proiectarea de medicamente ghidată pe structură moleculară. Deși valoarea cristalografiei macromoleculare cu raze X se va menţine pentru mulți ani graţie rezoluției mai ridicate, probabil că folosind ambele metode, cea cu raze X şi cea cu neutroni, ne se dezvăluie mai clar modul de interacțione al medicamentelor cu proteinele-ţintă, și astfel se va îmbunătăți eficienţa multor produse farmaceutice în viitor.
Difracţia neutronică
Când un cristal este plasat în dreptul unui fascicul de raze X, acestea interacționează cu norii de electroni ai atomilor din cristal, determinând difracţii în mai multe direcții. Prin măsurarea unghiurilor şi a intensităților sub-fasciculelor de difracție – sau ‘reflexii’ – putem realiza o imagine tridimensională a densității de electroni în interiorul cristalului, imagine din care pot fi determinate pozițiile medii ale atomilor.
Conceptual, difracția cu neutroni este foarte asemănătoare, cu diferența că neutronii sunt difractaţi de nucleele atomice ale rețelei cristaline, ci nu de nori de electroni din jurul lor. Astfel că urmele revelate prin dispersie, pentru diferite tipuri de atomi, nu se corelează cu configurația de electroni, ci după forțele nucleare, care diferă chiar şi de la un izotop la altul ai aceluiași element chimic.
Din cauza norilor de electroni mici, hidrogenul și deuteriul nu au un efect semnificativ asupra razelor X, dar ei pot determina o împrăştiere neutronică similară cu a celorlalte elemente din macromoleculele biologice: carbon, azot, oxigen și sulf. În consecință, hidrogenul și deuteriul nu sunt vizibile prin difraţia cu raze X, dar sunt vizibile folosind împrăștierea de neutroni.
Mai multe despre ILL
Institutul Laue Langevin-(ILL)w1 este un centru internațional de cercetări, cu sediul în Grenoble, Franța. IIL a fost în fruntea cercetării mondiale în domeniul științei și tehnologiei difracţiei cu neutroni pentru mai mult de 40 de ani, începând experimentele în 1972. ILL opereaza una dintre cele mai intense surse de neutroni din lume, generând fascicule de neutroni pentru o suită de 40 de instrumente de înaltă performanță, care sunt permanent modernizate. În fiecare an, aproximativ 1200 de cercetători din peste 40 de ţări vizitează ILL pentru a desfășura activități de cercetare în fizica materiei condensate, chimie, biologie, fizică nucleară și în știința materialelor.
ILL este membru al EIROforumw2, editorul revistei Science in School. Vedeţi lista tuturor articolelor despre ILL din Science in School:
References
- Cornuejols D (2009) Cristalele biologice: la interfaţa dintre fizică, chimie şi biologie. Science in School 11: 70–76.
Web References
- w1 – Obţineţi mai multe informaţii despre ILL.
- w2 – EIRO forum este un consorţiu format din opt cele mai mari organizaţii de cercetare ştiinţifică inter-guvernamentală din Europa, organizaţii care îşi combină resursele, facilităţile şi experienţa pentru a ajuta ştiinţa europeană să îşi atingă potenţialul maxim. Ca parte a activităţilor de educare şi informare publică, EIROforum editează revista Science in School.
Resources
- Difracția neutronică a ajutat cercetătorii să investigheze modul în care antigelul din sângele peștilor arctici îi ține în viață în condițiile temperaturilor sub zero grade. Citește mai mult pe:
- Blakely M, Hayes E (2011) Neutronii şi antigelul: cercetări privind peştii arctici. Science in School 20: 18–22.
Institutions
Review
Acesta este un articol interesant, ce ne arată cum evoluţiile din diferite ramuri ale științei – în acest caz difracția cu neutroni – pot fi utile în dezvoltarea de noi medicamente, pentru beneficiul omenirii.
Articolul poate servi drept lectură de pornire pentru profesori, și poate fi utilizat pentru a completa predarea disciplinelor științifice cu aplicații din viața reală. El ar putea fi folosit şi în activitățile de aprofundare sau de dialog/dezbatere cu elevii mai mari. Tipul de întrebări depinde de ceea ce profesorii ar dori să predea sau să accentueze. Un exemplu: „care este avantajul folosirii neutronilor în loc de raze X?”.
Paul Xuereb, Malta





