Spectrometria la școală: experimente practic-aplicative Teach article
radus de Luminița Chicinaș Inspectoratul Școlar Județean Cluj. În acest articol Natașa Gros, Tim Harrison, Irena Štrumbelj Drusany și Alma Kapun Dolinar prezintă o selecție de experimente care pot fi realizate cu ajutorul unui spectrometru simplu, proiectat special pentru a fi utilizat…

Maren Beßler / Pixelio
Pentru a motiva elevii din învățământul preuniversitar pentru învățarea practic-aplicativă a chimiei, noi, împreună cu partenerii noștri implicați în acest proiect, am dezvoltat o serie de experimente folosind spectrometre de dimensiuni reduse, realizate, de aemenea, cu costuri reduse. În cadrul proiectului am utilizat un spectrometru școlar simplu realizat de unul dintre partenerii noștri (Natașa Gros). Spectrometrul poate fi ușor modernizat/îmbunătătțit pentru a se obține alte instrumente analitice, de exemplu cromatografe pentru gaze sau lichide, oferind astfel posibilitatea de a dezvolta un domeniu mai larg de experimente școlare (vezi website-ul proiectuluiw1). De reținut că există un număr limitat de instrumente disponibile care pot fi împrumutate de către școli pe perioade limitate de timp.
Cum funcționează spectrometrele
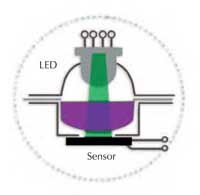
Într-un spectrometru, lumina albă provenită de la o sursă (o lampă) intră în monocromator din care iese doar lumina având lungimea de undă (culoarea) aleasă și trece apoi printr-o soluție în celula optică sau cuva (vezi Figura 1). Soluția absoarbe o fracțiune din lumină și un detector măsoară reducerea rezultată în intensitatea luminii (absorbanța). Cu cât culoarea soluției este mai închisă cu atât valoarea măsurată a absorbanței este mai mare.

Pentru imagine, multumim Nicola Graf
măsurare a spectrometrului
Spektra
Pentru imagine, multumi
m Nataša Gros
Cele mai utilizate cuve au o lungime a drumului optic de 1 cm și necesită cel puțin 3 ml de soluție pentru a obține o măsurătoare de succes. Principalul obiectiv al unui spectrometru utilizabil în scopuri generale îl constituie corectitudinea și precizia măsurării absorbanței: selectarea lungimii de undă ar trebui să fie făcută cât mai corect posibil, iar lumina să fie monocromatică (adică să aibă un doemniu cât mai îngust de lungimi de undă). În consecință, construcția instrumentului este complicată și nu este foarte evidentă pentru un utilizator obișnuit și din acest motiv instrumentul însuși este scump.
În schimb, obiectivul principal atunci când a fost realizat spectrometrul SpektraTM a constat în a produce un instrument robust, portabil și cu preț redus având un design și un mod de operare intuitiv și care să permită un consum redus de reactivi și totodată o concepție experimentală simplificată (Gros, 2004). Acest spectrometru a fost destinat în primul rând să răspundă unor scopuri educaționale, în special pentru introducerea conceptelor dar s-a dovedit, de asemenea, util pentru determinări punctuale cantitative sau semicantitative ale probelor.
Spektra constă din două elemente optice: o diodă (LED) care emite lumină în trei culori distincte și un senzor de lumină. Se poate selecta lumină albastră (430 nm), verde (565 nm) sau roșie (625 nm); lumina selectată tece printr-un strat lichid și apoi întâlnește senzorul (vezi Figura 2). Componentele esențiale (sursa de lumină, camera de măsurare și senzorul) sunt toate vizibile: astfel pentru elevi spectrometrul nu mai este o ”cutie neagră” ci este ușor de înțeles și de utilizat (vezi Figurile 3a și b).

Spektra spectrometer. A: the
LED light source; B: the
measuring chamber; C: the
measuring site with the
sensor at the bottom. Click
to enlarge image
Image courtesy of Nataša Gros

design. The instrument is
more compact, but the three
essential components (A:
light source; B: measuring
chamber; C: sensor) are still
visible. Click to enlarge image
Image courtesy of Nataša Gros
Reacțiile chimice și măsurătorile au loc în suporturi polimerice numite bule (asemănătoare ambalajelor de material plastic utilizate pentru medicamente sau obiecte fragile) care sunt potrivite pentru mici volume (0.35 ml) de soluții testate, reactivi omogenizați rapid cu reactivii și mici volume de reziduuri chimice. Lucrul experimental cu Spektra este simplu și sigur, fără să necesite nicio pregătire prealabilă în laborator și nici de reguli de lucru speciale. Volumele de soluții necesare sunt foarte mici: cihar și o abordare experimentală bazată pe picături poate fi adecvată.
Spectrometrul poate fi comandat onlinew2. Universitatea Bristolw3, Marea Britanie, oferă un număr limitat de spectrometre Spektra pentru a fi închiriate de către profesorii care doresc fie să exerseze experimentele cu elevii lor, fie să-și dezvolte propriile cercetări practice. Pentru profesorii care preferă un instrument convențional, calorimetrele Mystrica (folosind cuve normale cu scală completă) sunt de asemenea disponibile și de bună calitatew4.
Experimente practiv-aplicative în spectrometrie
Ca parte componentă a proiectului, cu scopul de a crește interesul pentru știință, de a inspira viitoare cariere de cercetători științifici printre elevii din învățământul preuniversitar, au fost dezvoltate o serie de activități practice de spectrometrie. Aceste activități acoperă teme și subiecte diverse cum ar fi analize ale apei, fizica luminii și culorilor, cercetări legate de legea Lambert-Beer, echilibrul chimic, analiza mediului înconjurător, cinetica reacțiilor chimice și analiza alimentelor.
Experimentele având ca subiect analiza alimentelor acoperă determinarea spectrometrică a nivelului ferului în probe de ierburi uscate sau făină; conținutul de alcool în băuturile spirtoase; nivelul glucozei în dulcețuri și gemuri; nivelul de fosfat în sucul de mere; fosfații și nitriții din produsele de carne; concentrația de caseină în brânză. Un alt protocol de investigare permite monitorizarea procesului de fermentare alcoolică.
În acest articol sunt prezentate, pas cu pas, indicațiile pentru experimentul care vizează determinarea nivelului de glucoză în gemuri; detalii complete ale celorlalte experimente – inclusiv unele potrivite pentru evenimente stiințifice prezentate elevilor din învățământul primar – sunt disponibile pe website-ul proiectuluiw1. Acest website oferă de asemenea instrucțiuni privind modul în care instrumentul Spektra poate fi modernizat ca și cromatograf cu gaz sau lichid, precum și detalii ale experimentelor care pot fi efectuate cu acest echipament modernizat (vezi de asemenea Gros & Vrtačnik, 2005).
Determinarea spectrometrică a nivelului glucozei în gem
Un număr de reacții între zaharuri și alți reactivi chimici au ca rezultat produși colorați; intensitatea culorii este corelată cu concentrația inițială a zaharului. Absorbanța soluțiilor probă poate fi măsurată și comparată cu absorbanța soluțiilor standard cu concentrații de zahăr cunoscute. Este cunoscut doar un număr limitat de reacții de schimbare a culorii polizaharidelor și majoritatea implică zaharuri simple, de regulă zaharuri reducătoare (vezi caseta).
Determinarea glucozei a fost aleasă în primul rând deoarece elevii cunosc ce sunt zaharurile – activitatea prezentând astfel un interes larg. Mai mult, determinarea conținutului de zaharuri în gem poate avea aplicații industriale prin aspectele legate de controlul calității produselor.
O metodă de a determina concentrația zaharurilor din gem implică hidroliza mai multor zaharuri nereducătoare (în cazul gemului, în principal sucroza) în glucoză folosind acidul sulfuric (H2SO4), după care proba este neutralizată cu hidroxid de sodiu (NaOH). Atunci când sunt încălzite cu acid 3,5 – dinitrosalicilic (DNSA; cunoscut și sub numele de acid 2-hidroxi-3,5-dinitrobenzoic) zaharurile reducătoare (de ex. glucoza și fructoza) duc la un produs roșu-maroniu. Pentru mai multe detalii referitor la această reacție vezi Miller (1959).
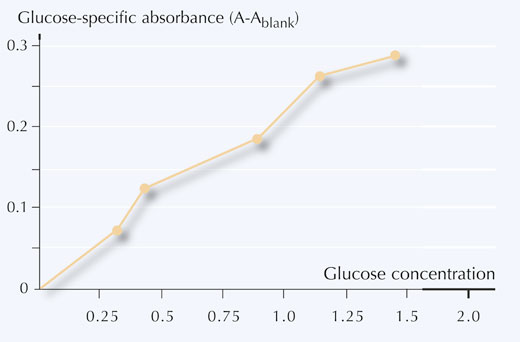
Concentrația complexului colorant poate fi determinată cu ajutorul spectrometrului folosind lumina albastră a LED-ului (430 nm): concentrația inițială de zaharuri în probele de gem poate fi citită din curba de calibrare obținută folosind concentrațiile cunoscute ale glucozei.
Echipament și reactivi
- Spectrometru Spektra (sau un alt spectrometru)
- Cuve sau bule
- Pipete
- Recipiente volumetrice de 100 ml
- Recipiente conice
- Tuburi de testare
- Balanță
- Baie de apă
- Pâlnie
- Hârtie de filtru
- Porbe de gem
- Reactiv DNSA (acid 3,5 dinitrosalicilic)
- Soluție de acid sulfuric (H2SO4) (aproximativ 2 mol/l)
- Soluție de hidroxid de sodiu (NaOH) (w=10%)
- Tartrat de sodiu și potasiu (NaK(CH2OH)2(COO)2.4H2O)
- Pudră de glucoză (C6H12O6)
Prepararea soluțiilor
Reactivul DNSA: Pentru a prepara reactivul DNSA dizolvați 10 g DNSA în 200 ml de soluție NaOH (cca 2 mol/l). Încălziți soluția și agitați continuu cu grijă. Dizolvați 300 g tartrat de sodiu și potasiu în 500 ml de apă distilată pentru a obține un stabilizator de culoare. Combinați cele două soluții, amestecați bine și umpleți până la 1 l cu apă distilată.
Gem (zaharuri): Cântăriți 1 – 2 g de gem într-un recipient conic și adăugați 10 ml de acid sulfuric. Încălziți apoi într-o baie de apă timp de 20 min amestecând periodic până când hidroliza este completă. Lăsați proba să se răcească și adăugați cu grijă 12 ml de hidroxid de sodiu. Amestecați și filtrați într-un recipient cu volumul de 100 ml și umpleți apoi cu apă distilată. Folosind o pipetă transferați 10 ml de soluție într-un alt recipient cu volumul de 100 ml și umpleți din nou până la vârf pentru a produce soluția test. Amestecați bine.
Gem (zaharuri reducătoare): Cântăriți 3.0 g de gem într-un recipient conic, adăugați 50 ml de apă distilată și apoi încălziți amestecând timp de 10 min. Filtrați produsul într-un recipient cu volumul de 100 ml și umpleți cu vârf cu apă distilată. Folosind o pipetă transferați 10 ml de soluție într-un alt recipient cu volumul de 100 ml și umpleți din nou cu apă distilată pentru a obține soluția test. Amestecați bine.
Soluția stoc de glucoză (15 mg/ml): Adăugați 1.5 g de glucoză într-un vas cu volumul de 100 ml, apoi umpleți până la vârf cu apă distilată. Amestecați.
Realizarea curbei de calibrare
- Marcați cinci recipiente, având fiecare volumul de 100 ml, cu litere de la A la E. În fiecare recipient astfel marcat adăugați cu ajutorul unei pipete volumele de soluție standard de glucoză și apă distilată respectând indicațiile specificate în Tabelul 1.
| Recipient | A | B | C | D | E |
|---|---|---|---|---|---|
| Volumul soluției de glucoză stoc (ml) | 2 | 3 | 6 | 8 | 10 |
| Volumul de apă distilată (ml) | 98 | 97 | 94 | 92 | 90 |
| Glucose concentration (mg/ml) | 0.3 | 0.45 | 0.9 | 1.2 | 1.5 |
2. Marcați și umpleți șase tuburi de testare așa cum este specificat în Tabelul 2.
| Numărul probei | Martor | 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|---|---|
| Soluția standard de glucoză (recipient) | N/A | A | B | C | D | E |
| Volumul soluției standard de glucoză (ml) | 0 | 1 | 1 | 1 | 1 | 1 |
| Volumul de reactiv DNSA (ml) | 1 | 1 | 1 | 1 | 1 | 1 |
| Volumul de apă distilată (ml) | 3 | 2 | 2 | 2 | 2 | 2 |

solutions
Image courtesy of Irena
Štrumbelj Drusany
- Încălziți tuburile de testare și conținutul lor în apă care fierbe timp de 5 min; reactivul DNSA va reacționa cu orice cantitate de zaharuri prezentă și va rezulta un podus roșu-maroniu.
- Răciți tuburile de testare, adăugați 6 ml de apă distilată în fiecare recipient și apoi agitați bine.
Folosind lumina albastră (430 ml) produsă de LED-ul spectrometrului măsurați transmitanța fiecărei soluții.
Citirile de pe instrumentul Spektra sunt transmitanțe exprimate în procente și ar trebui să fie împărțite la 100 pentru a obține valorile transmitanței care vor fi utilizate în calculele viitoare. Transmitanța este legată de absorbanță conform relației: A = –log T. Vezi coloanele a doua și a treia din Tabelul 3.
Imaginea din dreapta prezintă soluțiile de calibrare; chiar și proba martor (apă cu DNSA fără glucoză) are o culoare intensă. De aceea este necesar să se măsoare toate probele, inclusive proba martor, în comparație cu apa distilată. Absorbanța specifică glucozei din probe este apoi calculată prin scăderea valorii măsurate a absorbanței probei martor din valoarea măsurată a absorbanței fiecărei probe (vezi coloana a patra a Tabelului 3).
6. Trasați graficul concentrației glucozei în funcție de absorbanța specifică glucozei așa cum arată Figura 5.
Măsurarea probelor de gem
Probele de gem ar trebui tratate în mod asemănător cu tratarea soluțiilor de glucoză folosite pentru curba de calibrare.
- Pentru a testa fiecare tip de gem introduceți 1 ml de porbă preparată de gem (vezi ”Prepararea soluțiilor”) într-un tub de testare și adăugați 1 ml de reactiv DNSA și 2 ml de apă distilată.
- Încălziți tuburile de testare și conținutul lor în apă care fierbe timp de 5 min; reactivul DNSA va reacționa cu orice cantitate de zaharuri prezente rezultând un produs roșu-maroniu.
- Răciți tuburile de testare, adăugați 6 ml de apă distilată în fiecare tub și agitați bine.
- Folosind lumina albastră (430 nm) a LED-ului spectrometrului măsurați valoarea transmitanței (T%) fiecărei probe. Împărțiți cu 100 pentru a obține T, convertiți T în A folosind ecuația A = –log T și utilizați această valoare pentru a calcula absorbanța specifică glucozei (A – Ablank).
Tabelul 4 prezintă un exemplu cu valorile transmitanței obținute și cu absorbanța specifică glucozei pentru fiecare probă.
| Proba | Transmitanța (Citiri Spektra, T%) |
Absorbanța (A) |
Absorbanța specifică a glucozei (A – Ablank) |
|---|---|---|---|
| 1 | 18.6 | 0.73 | 0.17 |
| 2 | 21.3 | 0.67 | 0.11 |
- Folosind curba de calibrare pe care ați obținut-o transformați măsurătorile absorbanței (A) în concentrații ale glucozei (mg/ml) din probele voastre.
Folosind exemplele din Tabelul 4, valorile citite ale concentrațiilor glucozei din curba de calibrare dau:
Proba 1: 0.8 mg/ml
Proba 2: 0.5 mg/ml
6. Din concentrațiile glucozei calculați masa de glucoză din 1 g de probă de gem folosind următoarea ecuație:
Masa glucozei (g în 1g de probă) = concentrația masică (mg/ml) x 10 x 100 ml
Unde
concentrația masică este valoarea citită din curba de calibrare
10 este diluția (vezi ”Prepararea soluțiilor”)
100 ml este volumul a 1 g de probă de gem.
Pentru exemplul nostru,
Proba1: masa glucozei (g la 1 g de probă) = 0.8 mg/ml x 10 x 100 ml = 0.8 g
Proba 2: masa glucozei (g la 1g de probă) = 0.5 mg/ml x 10 x 100 ml = 0.5 g.
Calculele de mai sus consideră că proba inițială de gem a fost de 1 g. Dacă, de exemplu, proba a cântărit 2 g, valorile de mai sus trebuie împărțite la 2 pentru a obține masa de glucoză în g la 1 g de probă.
Zaharuri reducătoare și nereducătoare
În termeni chimici, un zahar reducător este o aldoză, cum ar fi glucoza, care are un grup de tip aldehidă care poate fi oxidat la acid carboxilic. Cel mai obișnuit test utilizat pentru a detecta zaharurile reducătoare constă în a le încălzi fie cu soluții Benedict, fie cu soluții Fehling care conțin ioni de cupru (II) care sunt reduși la oxid de cupru (I) și pot fi observate ca un precipitat maro-portocaliu.
Zaharurile nerudăcătoare, cum ar fi sucroza, pot avea mai degrabă un grup funcțional tip chetonă decât tip aldehidă și care nu poate reduce ionii de cupru (II). Atunci când sunt tratate cu soluții Benedict sau Fehling zaharurile nerudăcătoare nu produc precipitat colorat.
Mulțumiri
Autorii doresc să mulțumească Directoratului General al Comisiei Europene pentru Educație și Cultură pentru sprijinul financiar acordat proiectului Abordări practic-aplicative ale chimiei analitice pentru școlile vocaționale II (AnalChemVoc II, LLP-LDV-TOI-2008-SI-15) derulat prin programul Leonardo da Vinci.
References
- Gros N (2004) Spectrometer with microreaction chamber and tri-colour light emitting diode as a light source. Talanta 62: 143-150. doi: 10.1016/S0039-9140(03)00420-X
- Gros N, Vrtačnik M (2005) A small-scale low-cost gas chromatograph. Journal of Chemical Education 82: 291-293. doi: 10.1021/ed082p291
- Miller GL (1959) Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry 31: 426-428.
- Acest articol este dsiponibil gratuit pe website-ul Societății Americane de Chimie. Vezi: http://pubs.acs.org/doi/pdf/10.1021/ac60147a030
Web References
- w1 – Pentru mai multe informații despre proiect, vezi: www.kii2.ntf.uni-lj.si/analchemvoc2/file.php/1/HTML/experiments.htm
- w2 – Instrumentul Spektra poate fi comandat de la Laboratorijska tehnika Burnik: www.lt-burnik.si/index.php?newlang=english
- w3 – ChemLabS de la Universitatea Bristol (www.chemlabs.bris.ac.uk) oferă un număr limitat de spectrometre Spektra pentru a fi închiriate de profesorii care doresc fie să încerce experimentele împreună cu elevii lor fie să dezvolte alte investigații practice originale. Profesorii interesați îl pot contacta pe Tim Harrison (t.g.harrison@bristol.ac.uk).
- w4 – Pentru mai multe detalii despre calorimetrele Mystrica vezi: http://mystrica.com/Colorimeter.aspx. Website-ul descrie de asemenea un număr de experimente posibile; deosebit de interesante sunt cele care implică reacții ale enzimelor.
Review
Chimia analitică se bazează în mod extensiv pe analiza spectrometrică dar instrumentele profesionale sunt scumpe și de aceea nu sunt disponibile raportat la veniturile școlilor din multe țări. Acest articol prezintă un spectrometru dezvoltat de unul dintre autori pentru a face analiza spectrometrică accesibilă școlilor și liceelor. Website-ul proiectului oferă detalii referitor la câteva experimente care pot fi realizate în școli și licee, experimente din domeniul spectrometriei, protocolul de laborator al unui astfel de experiment fiind inclus în acest articol.
Recomand acest articol pentru introducerea chimiei analitice în lecțiile de științe ale naturii (nu numai chimie, ci și în biologie și științele mediului), în special pentru școli și licee care nu au laboratoare bine echipate și nici posibilitatea financiară de a le dota cu astfel de echipamente. Abordarea propusă este simplă și suficient de prietenoasă pentru a încuraja profesorii și elevii să încerce experimentele sugerate și să exploreze altele noi.
Profesorii pot folosi articolul pentru o discuție asupra metodologiei specifice spectrometriei și teoriei măsurătorilor spectrometrice. Analiza experimentală oferă oportunitatea de a analiza mathematic datele obținute, legând astfel chimia de statistică.
Articolul poate fi utilizat de asemenea ca un exercițiu de verificare a comprehensiunii. De exemplu:
- Fiind dată procedura de a realiza curba de calibrare din soluția standard stoc, completați tabelul următor:
| Recipient | A | B | C | D | E |
|---|---|---|---|---|---|
| Volumul soluției standard de glucoză (ml) | 2 | 3 | 6 | 8 | 10 |
| Volumul de apă distilată (ml) | 98 | 97 | 94 | ||
| Concentrația glucozei (mg/ml) | o.2 | 1.2 | 1.5 |
Giulia Realdon, Italia





