Pomaluje Twój świat na zielono Understand article
Od meduzy do wykrywaczy arsenu a po drodze jeszcze Nagroda Nobla: Sonia Furtado rozmawia z naukowcami z European Molecular Biology Laboratory (EMBL) w Heidelbergu (Niemcy) i przedstawia odkrycie oraz możliwości zastosowania zielono fluoryzującego białka w badaniach naukowych.
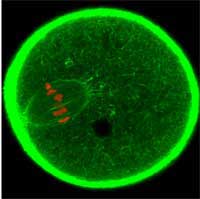
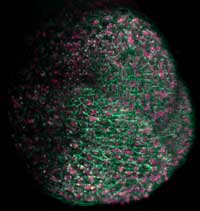
początek komórce jajowej. Za
pomocą GFP aktyna
cytoszkieletowa została
oznakowana na zielono a
chromosomy na czerwono
Zdjęcie dzięki uprzejmości Jan
Ellenberg / EMBL
Wszystko zaczęło się od zwykłej meduzy: przeźroczysta meduza Aequorea victoria posiada na granicy swojego „parasola” małe plamki, które po odpowiednim wzbudzeniu świecą na zielono – zjawisko to po raz pierwszy opisano w 1955. Odkrycie tej stosunkowo dziwnej cechy spowodowało rewolucję w metodologii badań naukowych oraz przyznanie Nagrody Nobla trzem naukowcomw1. Wszystko to z powodu jednego białka – zielono fluoryzującego białka (GFP, z ang. green fluorescent protein), umożliwiającego fluorescencję meduzy.
We wczesnych latach 60-tych japoński naukowiec Osamu Shimomura odkrył u meduzy tzw. aequorinę – białko, które w obecności wapnia (w komórce) świeci. Tylko, że aequorina świeci na niebiesko a meduza na zielono, – zatem potrzebne jest „coś”, co zamieni niebieskie światło aequoriny na zielone światło meduzy. Shimomura odkrył, że to „coś” to inne białko – GFP, które absorbuje światło niebieskie aeguoriny oraz ultrafiolet i emituje światło zielone, nadając meduzie ten kolor.
Następnie amerykański biolog Martin Chalfie zaproponował jak można by wykorzystać ten efekt: organizmy modelowe można by genetycznie zmodyfikować, dołączając gen kodujący GPF do genu, który jest celem zainteresowania naukowców. Następnie, w momencie, kiedy dany gen ulegnie ekspresji – czyli białko kodowane przez ten gen zostanie zsyntetyzowane, ekspresja ta obejmie również produkcję GFP. To pozwoliłoby naukowcom wiedzieć gdzie i kiedy dany gen ulega ekspresji: wystarczyłoby tylko wzbudzić ten organizm ultrafioletem i zobaczyć gdzie pojawi się zielone światło.
Wówczas pomysł Chalfiego był niewykonalny – brakowało dwóch podstawowych faktów: który gen koduje GFP i jaki jest mechanizm fluorescencji GFP. Naukowcy wiedzieli, że GFP świeci dzięki obecności 3 aminokwasów tworzących tzw. fluorofor, grupę funkcyjną (chemiczną) zdolną do absorbcji i emisji światła. Zakładali oni, że podobnie jak inne, znane już wtedy cząsteczki fluorescencyjne, inne białka tzw. enzymy, potrzebne są do uzyskania prawidłowego kształtu przez GFP i że enzymy te najprawdopodobniej produkowane są tylko przez A. victoria.
Gdy w 1992 biochemik Douglas Prasher zidentyfikował gen kodujący GFP, oczekiwano, że integracja tego genu w genom innego orgiazmu spowoduje ekspresję niefluorescencyjnego białka GFP. Jednak, ku zaskoczeniu Chalfiego i jego współpracowników po dołączeniu genu GFP do genomu bakterii, bakteria ta zaczęła świecić na zielono!
Okazało się, że GFP nie potrzebuje dodatkowych enzymów by mogło świecić. GFP spontanicznie układa się w konformacje fluorescencyjną i tworzy fluorofor. Biochemik Roger Tsien odkrył, że reakcja pomiędzy aminokwasami w fluoroforze wymaga tylko tlenu, który jest dostępny w prawie każdej żywej komórce.
Po odkryciu, w jaki sposób formowany jest fluorofor GFP, Tsien był w stanie zmanipulować genetycznie to białko. Zamieniając niektóre z aminokwasów w różnych miejscach sekwencji GFP, stworzył on nową wersję GFP. Tak zmodyfikowane GFP świeci intensywniej, jest w stanie zaabsorbować światło o różnych długościach fal oraz potrafi świecić w różnych kolorach np. na niebiesko czy żółto. Kiedy odkryte zostało czerwono fluoryzujące białko występujące u koralowców Tsien i jego współpracownicy wykorzystali swoje doświadczenie zdobyte podczas badań nad GFP i umożliwili użycie również tego białka, jako markera biologicznego.
W roku 2008 Shimomura, Chalfie oraz Tsien otrzymali Nagrodę Nobla w dziedzinie chemii za odkrycie i naukowe zastosowanie zielono fluoryzującego białka. Od tego czasu wielu naukowców na całym świecie pracowało nad kolejnymi wariantami GFP, które dziś dostępne jest w każdym możliwym kolorze.
Obecnie, GFP jest bezcennym narzędziem naukowców na całym świecie. GFP jest dużo mniej szkodliwe dla komórek w porównaniu z chemicznymi markerami fluorescencyjnymi. Normalnie po wzbudzeniu światłem fluorofor uwalnia elektron i emituje fluorescencję, jednak po krótkim czasie sygnał ten zanika na zawsze – ulega wygaszeniu.
Zdjęcie dzięki uprzejmości Typoform / the Royal Swedish Academy of Sciences (RSAS)

układa się w cylinder, w
centrum którego znajduje się
fluorofor
Zdjęcie dzięki uprzejmości
Typoform / the Royal Swedish
Academy of Sciences (RSAS)
Uwolniony w procesie wygaszania elektron bardzo szybko reaguje z obecnym w komórce tlenem i tworzy wysoko toksyczne rodniki tlenu uszkadzające komórkę. GPF jednak ma wyjątkową strukturę działającą jak tarcza, ochraniająca komórkę. Kiedy fluorofor uwolni elektron powstałe w tym procesie wolne rodniki reagują nie z tlenem a z GPF, uszkadzając tylko to białko a nie całą komórkę.
GFP często stosowane jest, jako barwny wskaźnik białek komórkowych, ale coraz częściej wykorzystywane jest ono również do śledzenia procesów o bardzo różnej skali czasowej i przestrzennej – używając GFP można zaznaczyć wszystko: od grup komórek do pojedynczych białek czy molekuł.
“To właśnie całe piękno GFP” mówi Darren Gilmour, naukowiec w EMBLw2: „Dzięki GFP możemy śledzić różne procesy w różnych skalach – używając tylko jednego białka”
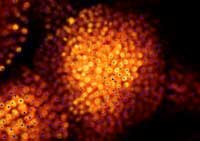
Darren i jej grupa badają rozwój embionalny ryby Danio pręgowany (ang. zebrafish). Używając GFP znakują oni grupy komórek by śledzić ich losy w procesie rozwoju: jak i gdzie one wędrują, jaką tkankę tworzą czy też, w jakiej tkance ostatecznie się osiedlają. Embriony Danio pręgowanego są przeźroczyste, dlatego wydawałoby się, że łatwo zobaczyć, co się odgrywa w jego wnętrzu. Problem polega na tym, mówi Darren, że dzieje się tam zbyt dużo na raz. „To jest ogromna liczba procesów zachodzących w tym samym czasie. W takich warunkach nie da się śledzić tylko jednego procesu. Można to jednak zrobić za pomocą GFP, Darren kontynuuje, przy wyłączonym świetle możemy śledzić tylko te grupy komórek czy pojedyncze komórki, które zostały oznakowane GFP” (Aby zdobyć więcej informacji na temat prac badawczych Darren Gilmour zobacz Spinney, 2007).
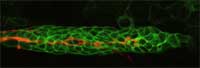
tu w kolorze
pomarańczowym, “wskazuje”
drogę migrującym komórkom
(zielone komórki) w
rozwijającym się embrionie
Danio pręgowanego
Zdjęcie dzięki uprzejmości
Darren Gilmour / EMBL
Możliwość śledzenia dynamicznych procesów za pomocą GFP jest również bardzo ważne dla Francesci Peri. Pozwala jej to oglądać na żywo rozwój, oznaczonych GFP, embrionów Dania pręgowanego pod mikroskopem przez kilka dni. Alternatywną techniką byłoby pobrać i porównać przekroje (a następnie ich zdjęcia) z embrionów w różnych stadiach rozwojowych. „ Ale to jakby próbować opowiedzieć mecz piłki nożnej na podstawie kilku zdjęć z meczu” mówi Francesca, „w taki sposób nigdy nie dowiemy się, co się wydarzyło i jak”. Francesca i jej grupa skupiają się na badaniu mikrogleju, komórek, które „zjadają” uszkodzone czy umarłe neurony. „Używając GFP możemy różnymi kolorami zaznaczyć różne rodzaje komórek np. mikroglej na zielono a neurony na czerwono. Jeśli zatem widzimy czerwoną komórkę w zielonej, wiemy, że neuron został pochłonięty przez mikroglej by zapobiec dalszemu uszkodzeniu tkanki mózgowej.
Marcus Heisler i jego grupa używają GFP do badań nad roślinami. Skupiają się oni na hormonie zwanym auksyna, który transportowany jest na zewnątrz komórki za pomocą transportera obecnego w membranie komórki. Transporter ten może przemieszczać się w komórce, zmieniając miejsce, w którym hormon te ulegnie wydzieleniu. Marcus mówi: „GFP umożliwia nam śledzenie tego bardzo aktywnego procesu w roślinie oraz umożliwia jego wizualizacje w trójwymiarowej rozdzielczości”.
Wydajność znakowania za pomocą GFP jest kluczowa by móc uzyskać trójwymiarową rozdzielczość obrazów, mówi Ernst Stelzer, który wraz ze swoją grupą rozwija trójwymiarowe technologie obrazowania. „Równomierne barwienie grubych czy gęstych preparatów (lub ich części) jest często bardzo trudne” mówi Ernst. Markery często nie są w stanie przesiąknąć przez preparat sprawiając, że barwienie jest nierównomierne: na powierzchni materiał jest dobrze zabarwiony, podczas gdy wewnętrzne jego warstwy słabo lub wcale. „Dzięki GFP, mówi Ernst, możemy być naprawdę pewni, że cały preparat będzie równomiernie oznakowany gdyż barwnik GFP produkowany jest we wnętrzu komórki”.
Inny naukowiec EMBL, Rainer Pepperkok mówi: “Dzięki GFP możemy śledzić biologię molekularną w komórce, gdzie wszystkie procesy zachodzą na żywo a nie w probówce”. On jak i inny naukowcy wykorzystują fakt, że GFP dostępne jest obecnie w różnych kolorach. Dodatkowo coraz popularniejsza staje się metoda oparta na fenomenie przenoszenia energii między dwoma fluorescencyjnym chromoforami (fluorescent resonance energy transfer, FRET).
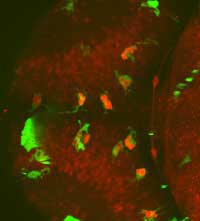
mogą śledzić procesy w
rozwijającym się mózgu
Danio pręgowanego, np.
obserwować interakcje
pomiędzy mikroglejem
(zielony) i komórkami
nerwowymi (czerwony)
Zdjęcie dzięki uprzejmości
Francesca Peri / EMBL
ilustracji tkanka twórcza
rzeżusznika, da początek
nadziemnej części rośliny.
Białka fluoryzujące zostały
użyte do oznakowania
membran komórkowych
(zielony) oraz jąder
komórkowych (różowy)
Zdjęcie dzięki uprzejmości
Ernst Stelzer / Marcus Heisler /
EMBL
zastosowaniu GFP do
znakowania białek, naukowcy
mogą porównać ich
komputerowe oszacowanie
występowania np. jądra
komórkowego w żywym
preparacie (zaznaczone tu na
niebiesko) z jego prawdziwą
lokalizacją w organizmie
(preparacie; pomarańczowy)
Zdjęcie dzięki uprzejmości
Marcus Heisler / EMBL
Zjawisko to zachodzi, kiedy dwie fluorescencyjne molekuły o różnych kolorach – np. czerwonym i zielonym – zbliżą się do siebie. Jeśli np. zielono fluoryzująca molekuła zostanie wzbudzona ultrafioletem lub światłem niebieskim, zaabsorbuje ona to światło i przeniesie część tej energii świetlnej na molekułę fluoryzującą na czerwono. Ta z kolei wyemituje czerwone światło – w podobny sposób jak w meduzie GFP świeci na zielono, gdy niebieskie światło emitowane jest przez aequorinę. Rainer tłumaczy: „Jeśli jedno białko oznakowane jest GFP a inne RFP (red fluorescent protein – czerwono fluoryzujące białko), to w momencie gdy białka te się spotkają – zachodzi interakcja między nimi, czerwona fluorescencja stanie się bardziej intensywna a zielona zblednie.
Mimo szerokich możliwości zastosowania GFP, a może właśnie, dlatego, naukowcy wciąż nie są usatysfakcjonowani. Życzyliby oni sobie odmiany GFP, które fluoryzują w świetle czerwonym i/lub podczerwieni (nie niebieskim czy ultrafiolecie) gdyż fale te lepiej penetrują preparaty biologiczne. „Poszerzyłoby to spektrum dostępnych kolorów GFP” mówi |Jan Ellenberg „ co z kolei pozwoliłoby na oznakowanie i śledzenie wielu białek jednocześnie”. Życzenie to może być stosunkowo trudne do spełnienia. Standardowe metody modyfikacji GFP (świecących dzięki wzbudzeniu falami długimi) poprzez dołączanie kolejnych aminokwasów do jego fluoroforu, zdaje się być wyczerpana.
Dodatkowo wymaga to dalszego rozwoju technik mikroskopowania, mówi Darren. „Genetycznie zmodyfikowany Danio pręgowany może posiadać 5 różnych białek świecących każdy w innym kolorze, mimo to brakuje odpowiedniej technologii obrazowania by śledzić 5 kolorów jednocześnie”.
GFP znajduje zastosowanie również poza działem naukowym. Świecące w ciemności zabawki, świecące w ciemności rybki akwariowe czy genetycznie zmodyfikowane bakterie wykrywające tlenek arsenu, trotyl (TNT) czy metale ciężkie.
I choć tyle udało nam się wyjaśnić za pomocą GFP, wciąż nie wiemy, dlaczego meduza posiada zdolność fluorescencji.
References
- Spinney L (2007) The great migration. Science in School 7: 20-23. www.scienceinschool.org/2007/issue7/migration
Web References
- w1 – Aby dowiedzieć się więcej na temat Nagrody Nobla w Dziedzinie Chemii w roku 2008, zobacz: http://nobelprize.org/nobel_prizes/chemistry/laureates/2008
- w2 – Aby dowiedzieć się więcej na temat EMBL i prowadzonych w tym instytucie badań naukowych, zobacz: www.embl.org





