Jak przechytrzyć podstępne sztuczki wirusa grypy? Understand article
Tłumaczenie Anna Bartosik. Złapanie wirusa grypy może oznaczać znacznie więcej niż tylko mały kłopot: te patogeny spowodowały najbardziej śmiertelne pandemie w naszej najnowszej historii. Claire Ainsworth prześledziła jak naukowcy pracują by zapobiec podobnym wydarzeniom w…
Zdjęcie dzięki uprzejmości
EMBL Photolab
Przypomina to ciągłą walkę z wirusami informatycznymi – jak tylko uda się pobrać najbardziej aktualne zabezpieczenia na komputer, to haker już odnajduje jego kolejny słaby punkt. I znowu maszyna jest na celowniku wirusów, wystawiona na działanie oprogramowania szpiegowskiego i innych szkodliwych programów. Aż znajdziemy nowe zabezpieczenia.
Komórki w naszym ciele napotykają na podobne problemy: one także maja wiele systemów zabezpieczeń aby osłonić swoje procesy biochemiczne przed atakami wirusów. Ale te systemy nie są perfekcyjne i wiele wirusów na drodze ewolucji wykształciło sprytne strategie by je złamać. Grupa naukowców z FLUPOLw1, inicjatywy przy Unii Europejskiej stara się zrozumieć te strategie by wynaleźć nowy system zabezpieczeń dla ludzkiego ciała. Udało im się obnażyć jedną z taktyk stosowanych przez wirusa grypy, tym samym torując drogę dla nowych leków do zwalczania przyszłych pandemii grypy.
Grypa stanowi poważny problem dla władz i organizacji zdrowia na całym świecie. Chociaż powszechne szczepy wirusa rzadko stanowią śmiertelne zagrożenie dla zdrowych ludzi, mogą okazać się zgubne dla osób starszych lub schorowanych, bądź z osłabionym układem odpornościowym. Co gorsza nowe szczepy cały czas ewoluują i mogą stać się bardziej niebezpieczne niż ich poprzednicy. Największym zmartwieniem jest jednak potencjał ptasiej grypy do nabycia zdolności łatwego infekowania ludzi. W przeszłości wirusy, które dokonały tego przeskoku były niezwykle zabójcze. Na przykład, pandemia grypy z roku 1918 (z greki pan: wszystko i demos: ludzie, epidemia choroby zakaźnej, która roznosi się przez populacje na przestrzeni dużego regionu, takiego jak kontynent lub nawet na cały świat), także wywodziła się od ptaków i zabiła od 50 do 100 milionów ludzi na świecie. Była to najbardziej śmiertelna pandemia w najnowszej historii.
W ciągu ostatnich kilku lat strachem napawał szczep wirusa ptasiej grypy nazwany H5N1 (zobacz także Niekoop & Rienks, 2006), który już zdążył zainfekować i zabić kilkaset ludzi na całym świecie. Jeżeli w krótkim czasie nabędzie on zdolność do przenoszenia się z człowieka na człowieka, to możemy stać się świadkami nowej, śmiertelnej pandemii. Szczepionki przeciwko grypie istnieją, ale te które działają na jeden szczep wirusa, często mają ograniczony wpływ na inne szczepy. Potrzeba dużo czasu by powstały szczepionki przeciwko nowym szczepom. Gdy więc dojdzie do zagrożenia, może być za późno by zapobiec nowej pandemii. Dlatego bardzo potrzebne są nowe sposoby by zatrzymać rozprzestrzenianie się wirusa.
Kiedy wirus grypy infekuje komórki organizmu-gospodarza jego celem jest produkcja jak największej liczby swoich kopii, tak by móc atakować kolejne komórki. Kluczem do tego procesu jest wirusowy enzym, polimeraza, składający się z trzech podjednostek. Enzym ten kopiuje materiał genetyczny wirusa i steruje maszynerią komórki gospodarza tak, by produkowała białka wirusowe. Dzieje się to w procesie zwanym odłączanie CAPu („czapeczki”) (patrz schemat). CAP jest krótkim odcinkiem RNA, który musi być obecny na początku każdego informacyjnego RNA (messenger RNA, mRNA). Jest on potrzebny by kierować komórkową maszynerię syntezy białek do jej miejsca początkowego, tak by mogła zachodzić synteza białek zgodnie z informacją zawartą w mRNA. Wirusowa polimeraza przejmuje CAP z komórkowych cząsteczek RNA i dodaje ją do początku wirusowego mRNA. Ale to, jak dokładnie zachodzi ten proces i która z trzech podjednostek polimerazy odpowiada za poszczególny etap pozostaje niewyjaśnione.
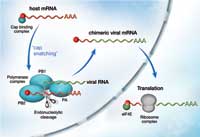
od mRNA gospodarza z pomocą
białka PB2, które jest częścią
kompleksu polimerazy.
Po przyłączeniu czapeczki RNA
wirusa może podlegać translacji
w białka przy pomocy rybosomów
w cytoplazmie, w wyniku czego
produkowane jest więcej cząstek
wirusa. Kliknij na obrazek aby
powiększyć
Zdjęcie dzięki uprzejmości
Petra Riedinger
Biochemia wirusowej polimerazy jest najprawdopodobniej bardzo różna od ludzkich białek. Dlatego też jest ona bardzo atrakcyjnym celem badań nad lekami, które mają zahamować tempo rozprzestrzeniania się infekcji w organizmie. Różnice zmniejszają ryzyko uszkodzenia ludzkich białek jako efekty uboczne terapii.
Nauka o polimerazie jest kluczem do zrozumienia jak grypa może przenosić się miedzy gatunkami. Kilka mutacji, które umożliwiają ptasiej grypie życie w komórkach ludzkich, zachodzi w samej polimerazie, dlatego istotnym jest dowiedzieć się co one właściwie robią. To nie jest łatwe zadanie i w dodatku wymaga szerokiego zakresu wiedzy. Inicjatywa FLUPOL Unii Europejskiej została utworzona by sprostać temu zadaniu: zespoły badawcze Stephena Cusacka i Darrena Harta z oddziału zamiejscowego EMBL w Grenoblew2 (Francja) razem ze współpracownikami z Grenoble Unit of Virus Host Cell Interactionw3, złączyli siły z innymi europejskimi zespołami w Madrycie, Lyonie, Londynie i Marburgu. „Dzięki temu możliwe było wielodyscyplinarne podejście do badań tego enzymu, począwszy od bioinformatyki, przez strukturę aż po mysie modele transmisji międzygatunkowej” podkreśla Stephen.
Polimeraza jednak nie ujawnia łatwo swych sekretów. Przez wiele lat niemożliwym było pozyskanie szczegółowych informacji na temat jej struktury trójwymiarowej. Aby to osiągnąć, naukowcy najpierw muszą wyprodukować białka składowe polimerazy w formie rozpuszczalnej i uzyskać ich kryształy. Poprzez świecenie promieniami rentgenowskimi na kryształy, naukowcy są w stanie wydedukować struktury tych białek aby lepiej zrozumieć jak one funkcjonują. Po wprowadzenie do krystalografii zajrzyj do artykułu napisanego przez Dominique Cornuéjols w tym numerze. Możesz również sam spróbować krystalizacji białek w klasie (Blattmann & Sticher 2009).
Przez długi czas nikomu nie udało się uzyskać wszystkich ważnych kryształów. W trakcie kolejnych prób, okazywało się, że białka formowały bezużyteczne, nierozpuszczalne grudki, albo że naukowcy nie mogli wyprodukować wystarczającej ilości białka w rozpuszczalnej formie. Frustrującym było też to, że nie mogli uciec się do zwykłej strategii w takich wypadkach czyli fragmentacji białka na indywidualne części, zwane domenami w nadziei, że one okażą się rozpuszczalne. Ta metoda opiera się na wcześniejszej identyfikacji poszczególnych domen. Biologowie zwykle osiągają to poprzez porównanie sekwencji aminokwasowej danego białka z tymi białkami, których struktury są już znane. Ale polimeraza wirusa grypy nie jest podobna do żadnego innego białka, dlatego takie podejście nie jest możliwe.

Zdjęcie dzięki uprzejmości EMBL
Photolab
Pomocny okazał się nowy zautomatyzowany system wynaleziony przez Darrena. System nazywa się ESPRIT (Expression of Soluble Proteins by Random Incremental Truncation) i pozwala naukowcom na przeszukiwanie wszystkich możliwych fragmentów białka w celu szybkiego i prostego znalezienia odpowiednich rozpuszczalnych domen. W 2007 roku Darren i Stephen wykorzystali ESPRIT do uzyskania pierwszego rozpuszczalnego fragmentu PB2, czyli jednej z trzech podjednostek (PA, PB1, PB2), która składa się na polimerazę wirusa grypy (Tarendeau et al., 2007).
Po określeniu struktury tego fragmentu naukowcy odkryli, jak pomaga on podjednostce PB2 dostać się do jądra komórki, gdzie składa się ona z pozostałymi dwiema podjednostkami w funkcjonalną polimerazę.
Stephen i Darren byli szczególnie zainteresowani innym regionem podjednostki PB2, który odgrywa kluczową rolę w procesie odłączania CAPu. Podjednostka PB2 wiąże mRNA komórki gospodarza poprzez CAP, a następnie podjednostka PB1 polimerazy odcina CAP i dodaje ją na początek wirusowego mRNA. Wirusowy mRNA z dołączonym CAP może być rozpoznane przez maszynerie komórkową, która pozwala na produkcje wirusowych białek kosztem białek komórkowych. Bez „czapeczki” mRNA nie może być zamienione na białka. Więc leki, które blokują wiązanie PB2 do CAPu, mogą zahamować namnażanie wirusa grypy.
Jednakże do tej pory niewiele było wiadomo o tym jak działa PB2. „Badania trwały przez wiele lat, ale nikt nie był pewien, gdzie dokładnie znajduje się domena wiążąca „czapeczkę” opowiada Stephen.
Dzięki ESPRIT, Darren, Stephen i współpracownicy znaleźli fragment PB2, który wiąże CAP. Z pomocą laboratorium wysoko-przepustowej krystalizacji w EMBL, Grenoble i wiązek intensywnego synchrotronowego promieniowania X w European Synchrotron Radiation Facility (ESRF)w4 (patrz Cornuéjols, 2009), opisali oni strukturę domeny wiążącej „czapeczkę” PB2 wraz z CAP. To ujawniło, że domena ta posiadała strukturę, której nigdy wcześniej nie zaobserwowano. „Jest zupełnie różna od innych białek o podobnym pofałdowaniu” mówi Stephen.
Ale pomimo, że struktura była zupełnie nowa, to sposób w jaki domena oddziaływała z „czapeczką” opiera się na tych samych zasadach co w przypadku innych białek wiążących CAP: centralne miejsce oddziaływania jest „kanapką” z dwoma aminokwasami podjednostki PB2 umieszczonymi po obu stronach „czapeczki” (patrz schemat) „Jest to ładny przykład ewolucji konwergentnej, gdzie białka o kompletnie różnym pochodzeniu stosują to samo rozwiązanie” – opowiada Darren.
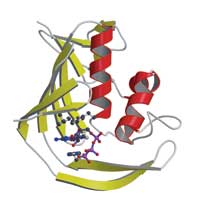
PB2, wirusa grypy, pokazuje jak wirus
przejmuje „czapeczkę” od gospodarza.
PB2 wiąże CAP (zaznaczone) poprzez
umieszczenie jej pomiędzy
aminokwasami aromatycznymi.
Kliknij na obrazek aby powiększyć
Zdjęcie dzięki uprzejmości Petra Riedinger
Aby udowodnić, że faktycznie zanalizowany przez nich fragment był sprawca przejęcia „czapeczki”, Darren i Stephen stworzyli fragmenty zawierające zmutowane aminokwasy przylegające do CAPu. Zgodnie z oczekiwaniem, większość zmutowanych fragmentów nie oddziaływała z „czapeczką”. Ponadto, jak wykazali współpracownicy z FLUPOL w Centro Nacional de Biotecnologia w Madryciew5, te same mutacje blokowały zdolność całej polimerazy do produkcji nowych wirusów. „Byliśmy w stanie wykazać jakie ma to decydujące znaczenie dla wirusa jako całości” podkreśla Stephen (Guilligay et al., 2008).
Teraz, kiedy znana jest już struktura, naukowcy mogą ją wykorzystać do projektowania stosunkowo prostych, małych cząsteczek, które zablokują działanie PB2. Według Stephena „Jeżeli możesz zahamować przejęcie „czapeczki”, to możesz zabić wirusa”. Razem z Darrenem, szykują się do szukania potencjalnych leków, które właśnie to zrobią. Korzystając ze struktury projektują inhibitor, ale również wykorzystują potencjał do produkcji dużych ilości fragmentu PB2 w celu wyszukiwania w kolekcji związków chemicznych innych molekuł, które mogą wiązać PB2 – potencjalnych inhibitorów PB2. „Jesteśmy pierwszymi ludźmi, którzy są w stanie przy pomocy tej nowej metody w pełni wykorzystać ten fragment białka do zidentyfikowania mało-cząsteczkowych inhibitorów” mówi Darren.
Niedawno naukowcy w UVHCI i z zespołu Stephena odkryli, że część podjednostki PA, trzeciej podjednostki wirusowej polimerazy, jest odpowiedzialna za odcinanie CAPu od mRNA gospodarza (Dias et al., 2009). Te wyniki okazały się dużym zaskoczenie, ponieważ wszyscy myśleli, że za cięcie odpowiada inne miejsce w cząsteczce polimerazy. Dlatego też PA stało się kolejnym potencjalnym celem leków antywirusowych.
Naukowcy wyprodukowali kryształy kluczowej domeny PA i przebadali je przy pomocy silnych promieni X w ESRF Grenoble. Uzyskali zdjęcia o wysokiej rozdzielczości, które ujawniły poszczególne aminokwasy składające się na miejsce aktywne odpowiedzialne za oddzielanie „czapeczki” od RNA. Wydrążony kanion w środku domeny PA chwyta długą nić mRNA, a kompleksy metali na górnych brzegach kanionu odcinają CAP. Dalsze eksperymenty przeprowadzone w ESRF potwierdziły, że kompleksy metali zawierają mangan. Odkrycie to dostarcza wskazówek dla rozwoju leków, ponieważ koniecznym jest wzięcie pod uwaga obecności jonów metali w projektowaniu ulepszonych inhibitorów. Cały trik polega na wykorzystaniu wiedzy o strukturze miejsc aktywnych podjednostek wirusowej polimerazy – które są odpowiedzialne albo za wiązanie ligandu albo maja aktywność enzymatyczną – do projektowania mało-cząsteczkowych inhibitorów, które mogą specyficznie blokować te miejsca, a co za tym idzie namnażanie wirusa.
Te odkrycia uwidoczniły naukowcom prawie kompletny obraz mechanizmu przejęcia „czapeczki”. Obecnie badacze wykorzystują ESPRIT by rozwikłać resztę struktury polimerazy wirusa grypy w nadziei, że w najbliższej przyszłości, uda im się obnażyć nowe sposoby przeciwdziałania brudnym sztuczkom grypy.
References
- Blattmann B, Sticher P (2009) Growing crystals from protein. Science in School 11: 30-36. www.scienceinschool.org/2009/issue11/lysozyme
- Cornuéjols D (2009) Biological crystals: at the interface between physics, chemistry and biology. Science in School 11: 70-76. www.scienceinschool.org/2009/issue11/crystallography
- Dias A, Bouvier D, Crépin T, McCarthy AA, Hart DJ, Baudin F, Cusack S, Ruigrok RW (2009) The cap-snatching endonuclease of influenza virus polymerase resides in the PA subunit. Nature 458: 914-918. doi: 10.1038/nature07745. Pobierz artykuł za darmo tutaj albo zaprenumeruj Nature dzisiaj: www.nature.com/subscribe
- Guilligay D Tarendeau F, Resa-Infante P, Coloma R, Crepin T, Sehr P, Lewis J, Ruigrok RW, Ortin J, Hart DJ, Cusack S (2008) The structural basis for cap-binding by influenza virus polymerase subunit PB2. Nature Structural and Molecular Biology 15(5): 500-106. doi: 10.1038/nsmb.1421
- Niekoop L, Rienks F (2006) Ptasia grypa z punktu widzenia ekologa. Science in School 3. www.scienceinschool.org/2006/issue3/birdflu/polish
- Tarendeau F, Boudet J, Guilligay D, Mas PJ, Bougault CM, Boulo S, Baudin F, Ruigrok RW, Daigle N, Ellenberg J, Cusack S, Simorre JP, Hart DJ (2007) Structure and nuclear import function of the C-terminal domain of influenza virus polymerase PB2 subunit. Nature Structural and Molecular Biology 14(3): 229-33. doi: 10.1038/nsmb1212
Web References
- w1 – Aby dowiedzieć się więcej o inicjatywie EU FLUPOL, zobacz: www.flupol.eu
- w2 – Tutaj możesz znaleźć stronę interentową stacji European Molecular Biology Laboratory (EMBL) w Grenoble: www.embl.fr
- w3 – Aby dowiedzieć się więcej o Unit of Virus Host Cell Interactions w Grenoble, zobacz: www.uvhci.fr
- w4 – Aby uzyskać więcej informacji o European Synchrotron Radiation Facility (ESRF) w Grenoble, zobacz: www.esrf.eu
- w5 – Aby dowiedzieć się więcej o Centro Nacional de Biotecnologia w Madrycie, zobacz: www.cnb.uam.es





