Zmrożona nauka Understand article
Tłumaczenie Marta Tondera. Kiedy schładzamy jakąś substancję poniżej jej temperatury zamarzania, jej stan skupienia zmienia się na stały - przynajmniej tego się spodziewamy. Tobias Schülli bada, dlaczego nie zawsze tak się dzieje.

ktsimage / iStockphoto
Jak to możliwe, że chmury na dużej wysokości, w temperaturze poniżej 0 °C, składają się z drobnych kropelek wody, a nie z lodu? W rzeczywistości ciecze w pewnych warunkach, mogą pozostać płynne dużo poniżej temperatury krzepnięcia. Mimo że to zjawisko, znane jako przechłodzenie, zostało odkryte już w 1724 roku przez Daniela Gabriela Fahrenheita (Fahrenheit, 1724), ciągle jest przedmiotem wielu badań.
Różne stany skupienia
Dla naukowców ciecz jest interesującym stanem skupienia między uporządkowanym a nieuporządkowanym. Najlepszym przykładem nieuporządkowanego stanu materii jest gaz doskonały: ruchy termiczne pojedynczych atomów (lub cząsteczek) są tak ważne, że siły przyciągania między nimi nie mają znaczenia i mogą się one bez przeszkód poruszać w przestrzeni. Zarazem jednak w stałym stanie skupienia każdy atom pozostaje na swoim miejscu, ściśle przywiązany do swoich „sąsiadów”. Wskutek optymalizacji wiązań chemicznych i ich energii atomy są gęściej ułożone, w powtarzalnej, trójwymiarowej strukturze, nazwanej kryształem. Stąd to, co nazywamy ciałem stałym, jest zazwyczaj krystalicznym ciałem stałym.
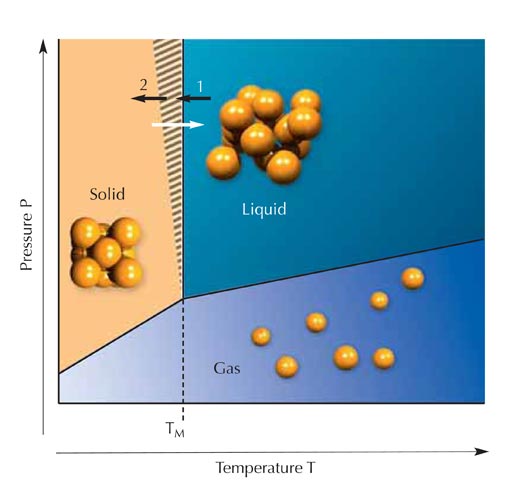
W cieczy, pośrednim stanie skupienia, sąsiadujące ze sobą atomy stykają się tak jak w ciałach stałych (obydwa te stany są nazywane materią skondensowaną), ale pojedyncze atomy mogą się swobodnie poruszać, zapobiegając powstawaniu idealnego wzoru kryształu. W ten sposób gęstość cieczy (w porównaniu z gazem) niewiele różni się od gęstości ciał stałych (patrz rysunek 1).

a) W ciele stałym lub krystalicznym każdy atom pozostaje w tym samym miejscu. Można o nim powiedzieć, że jest ściśle przywiązany do otaczających go atomów. Jeśli podgrzejemy kryształ, atomy zaczną się poruszać (drgania cieplne).
b) W stanie ciekłym (w temperaturze powyżej punktu topnienia) ruch termiczny pozwala pojedynczym atomom swobodnie się poruszać, chociaż siły przyciągania między nimi sprawiają, że są one prawie tak blisko siebie jak w ciele stałym. Dlatego też ciecz ma prawie tę samą gęstość co ciało stałe i jest nieściśliwa tak samo jak ono.
c) W podwyższonej temperaturze ruch cieplny pojedynczych atomów gazu staje się tak ważny, że siły przyciągania między atomami przestają mieć znaczenie i atomy mogą swobodnie się poruszać. Gęstość gazu zależy od ciśnienia i temperatury otoczenia. Przy wysokim ciśnieniu lub niskiej temperaturze atomy mogą z powrotem łączyć się ze sobą w gęstsze formy, by utworzyć ciecz lub ciało stałe. Właśnie dlatego te dwa stany są nazywane materią skondensowaną.
Zdjęcie dzięki uprzejmości Tobias Schülli
Zdjęcie dzięki uprzejmości Tobias Schülli

jest w stanie metastabilnym;
pozostanie w tym stanie
tylko, jeśli warunki się nie
zmienią. Niebieskie kółko
jest w stanie przejściowym
(niestabilnym) i dąży do
stanu stabilnego,
pokazanego przez czarne
kółko. Każdy niestabilny stan
będzie dążył do stabilności,
podczas gdy stan
metastabilny wymaga
określonych warunków, żeby
zrobić to samo
Zdjęcie dzięki uprzejmości
Tobias Schülli
Mimo że ciecze są uznane za nieuporządkowane, atomy mogą miejscami łączyć się w małe grupy, które określa się jako lokalny porządek. Właściwości fizyczne tego stanu bardzo trudno sprawdzić doświadczalnie, ale uważa się, że lokalny porządek odgrywa główną rolę w przechodzeniu substancji z fazy nieuporządkowanej do uporządkowanej.
To, czy dana substancja jest w stanie gazowym, stałym lub ciekłym, zależy od temperatury i ciśnienia. Pod ciśnieniem atmosferycznym lód topi się w temp. 0 °C, rtęć w temp. -39 °C, a złoto 1064 °C. Gdy te substancje zostaną ogrzane, ciała stałe (kryształy) stopią się dokładnie w podanych temperaturach. Jednakże ta reguła nie zawsze działa w drugą stronę: kiedy ciecz jest schłodzona do temperatury krzepnięcia, utworzenie kryształu jest możliwe, ale nie zawsze następuje dokładnie w tej temperaturze (rysunek 2). W zakreskowanym obszarze na rysunku czysta ciecz (bez centrów krystalizacji) pozostanie cieczą. O takiej cieczy mówi się, że jest przechłodzona. Ten stan skupienia jest nazywany metastabilnym (rysunek 3).
Jak wytłumaczyć przechłodzenie?
Pierwsze wytłumaczenie przechłodzenia pochodzi z fizyki krystalizacji. Do formowania kryształu potrzebny jest ośrodek z regularnie ułożonych atomów, wokół którego kryształy mogą rosnąć. Krystalizacja normalnie zachodzi, kiedy ciecz ma kontakt z ciałem stałym lub zawiera centra krystalizacji; dzieje się tak, jak gdyby ciecz naśladowała uporządkowaną strukturę sąsiedniej powierzchni. Ten proces nazywa się zarodkowaniem heterogenicznym, które jest rozpoczynane przez zarodek.
Przy braku krystalicznego ciała stałego samorzutne utworzenie dużej regularnej struktury z nieuporządkowanej cieczy jest mało prawdopodobne. Mimo że niewielka liczba atomów może samoczynnie stworzyć regularny układ, skupiska te są zwykle zbyt małe, by być ośrodkiem krystalizacji i szybko z powrotem rozpuszczają się w cieczy. Czysta ciecz musi być zatem znacznie przechłodzona, aby nastąpiło zarodkowanie homogeniczne; kilka atomów w cieczy samorzutnie ustawi się w odpowiedni sposób, aby utworzyć dostatecznie duży i stabilny kryształ, który będzie mógł służyć jako zarodek dla dalszego przyrostu (rysunek 4).

a) Formowanie kryształu zaczyna się zazwyczaj wokół krystalicznego ciała stałego w kontakcie z cieczą (zarodkowanie heterogeniczne).
b) W konsekwencji ciecz musi zostać znacznie przechłodzona, aby zaszło zarodkowanie homogeniczne: część atomów w cieczy samorzutnie ustawia się we właściwej pozycji, by stworzyć kryształ, który potem służy jako jądro do dalszego wzrostu .
Zdjęcie dzięki uprzejmości Tobias Schülli
Większość malutkich kropel wody, które tworzą warstwowe i kłębiaste chmury, nie zawiera zarodków kryształów; te krople mogą pozostać cieczą w temperaturze znacznie niższej niż 0 °C.
Głębokie przechłodzenie w metalach
Bardziej spektakularne od wody, która może być przechłodzona tylko do ok. 40 stopni poniżej temperatury topnienia 0 °C, są metale, które mogą pozostać ciekłe nawet kilkaset stopni poniżej ich punktu krzepnięcia. To zjawisko jest znane jako głębokie przechłodzenie i wymagało od naukowców sięgnięcia poza teorię zarodkowania kryształów, aby wytłumaczyć metastabilność cieczy (Turnbull, 1952).
Naukowcy podejrzewali, że struktura wewnętrzna niektórych cieczy może być niezgodna z krystalizacją. W latach 50. Frederick Charles Frank zasugerował, że gęstsze ułożenie niewielkiej liczby atomów może być inne niż w miejscowo powstającym krysztale i że te skupiska w cieczy są ułożone w sposób uniemożliwiający im służenie jako centrum krystalizacji (Frank, 1952).

Zdjęcie dzięki uprzejmości Nicola Graf
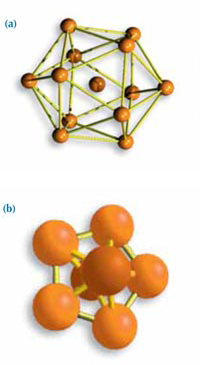
struktur niekompatybilnych z
tworzeniem kryształu:
(a) Dwudziestościan,
możliwie najgęstsze ułożenie
dla trzynastu atomów.
(b) Skupisko siedmiu atomów
z pięciokątną symetrią.
Zdjęcie dzięki uprzejmości
Tobias Schülli
Jako modelu Frank użył dwudziestościanu; centralnego atomu z dwunastoma kolejnymi dookoła. Taka struktura o pentagonalnej symetrii nie może stanowić podstawy kryształu. Ogólnie biorąc, struktura krystaliczna musi się powtarzać w trzech wymiarach, jak cegły w ścianie. Na przykład ułożenie sześcienne jest dla kryształu idealne, ponieważ jest zarówno gęste, jak i regularne.
Używając dwuwymiarowego porównania, trójkąty, prostokąty czy sześciany idealnie układają się na płaszczyźnie, w przeciwieństwie do pięciokątów (rysunek 5). W trzech wymiarach pięciokątne struktury nieodpowiadają tworzeniu kryształu (rysunek 6).
Najnowsze symulacje i modele teoretyczne potwierdzają pomysł Franka, sugerując, że znaczna część atomów w cieczach sama ustawia się w skupiska z pięcioosiową symetrią, co stanowi przeszkodę w krystalizacji. Jednakże do tej pory niewiele eksperymentów pozwoliło na wizualizację pięciokątnej symetrii w cieczach (Reichert et al., 2000).
Przechłodzenie w półprzewodzących nanostrukturach
Moje pierwsze zetknięcie się z fenomenem przechłodzenia było przypadkowe. Właściwie tematem mojego badania w zespole w CEAw1 w Grenoble we Francji było zrozumienie i poprawienie nowoczesnych metod wzrostu półprzewodnikowych nanostruktur. W tych metodach procesy krzepnięcia i zarodkowania są decydujące. Uwagę naszego zespołu przyciągnął raport o przechłodzeniu kropli metalowych półprzewodzących stopów: te krople pozwoliły nam na badanie wpływu krystalicznego zarodka (krzemowa powierzchnia) na krzepnięcie stopu.
Umieściliśmy drobne kropelki (0,1-0,2 µm) płynnego stopu złota z krzemem na powierzchni krzemowej przygotowanej wcześniej w warunkach próżni, standardowej procedurze używanej w przetwarzaniu półprzewodników. Zaobserwowaliśmy, że podczas kontaktu z krystaliczną powierzchnią krople pozostały płynne w temp. 240 °C, dużo poniżej ich punktu krzepnięcia (363 °C). Żeby zrozumieć to nadzwyczajne zjawisko przechłodzenia (zazwyczaj obserwowane przy braku zarodków krystalicznych), przeprowadziliśmy eksperyment w European Synchrotron Radiation Facility (Europejskim Ośrodku Synchrotronu Atomowego)w2, także w Grenoble. Rozproszenie bardzo intensywnych promieni rentgenowskich wytworzonych w synchrotronie jest jedyną drogą, aby otrzymać informacje o ułożeniu atomów w cieczy i na powierzchniach ciał stałych.
Ustawiliśmy promienie niemalże równolegle do powierzchni kryształu krzemowego, na którym zostały umieszczone krople stopu złota z krzemem. Pod kątem zaledwie 0,1° (technika nazwana „grazing incidence”), promienie rentgenowskie odbijają się od powierzchni krzemu i przenikają krople. Rozproszenie promieni dostarcza informacji o ułożeniu atomów w warstwie krzemu krzemu oraz w strukturze kropli.
Te doświadczenia pozwoliły określić nam stan skupienia (ciekły lub krystaliczny) schłodzonych kropli i dokładne rozmieszczenie atomów górnej warstwy powierzchni krzemu. Wyniki promieniowania pokazały, że w najwyższej warstwie powierzchni krzemu atomy były ułożone w pięciokątnej symetrii. Na takiej powierzchni krople pozostawały ciekłe nawet po schłodzeniu ponad 100 stopni poniżej ich temperatury krzepnięcia.
Dokładniejsza analiza powierzchni kontaktu między cieczą i ciałem stałym pokazała, że te pięciokątne struktury na powierzchni tworzyła pojedyncza warstwa atomów złota ściśle przylegająca do kryształu krzemu. Jak wytłumaczono powyżej, zwykle spodziewamy się naśladowania struktury ciała stałego przez ciecz, gdy są one w kontakcie wywołującym zarodkowanie heterogeniczne. Nasze pomiary pokazały, że takie naśladowanie struktury powierzchni zachodzi, ale może mieć odwrotny skutek: struktura niekompatybilna z tworzeniem trójwymiarowego kryształu może wymusić na cieczy miejscowe przejęcie „złego” ustawienia. Zamiast wywoływania zarodkowania heterogenicznego, powoduje to stabilizację przechłodzonej fazy cieczy (patrz rysunek 7).
Po 60 latach badań nad przechłodzeniem metali doświadczenie to ostatecznie unaocznia, że pięcioosiowa symetria wpływa na metastabilność cieczy (Schülli et al., 2010; Greer, 2010).
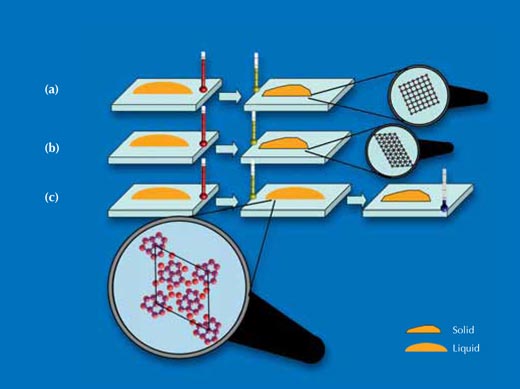
(a) Gdy kryształ krzemowy został rozcięty wzdłuż sześciennych ścianek, atomy krzemu na powierzchni kontaktującej się z kroplami układały się w kwadratową sieć. Na tej powierzchni krople krystalizowały się ok. 60 K poniżej ich punktu krzepnięcia. Wyniki prześwietlenia pokazały, że krople skrystalizowały w formie i kierunku podobnych do kryształu krzemu, na którym osiadły.
(b) Gdy kryształ krzemu przecięto wzdłuż przekątnej sześcianu, atomy krzemu na powierzchni kontaktującej się z kroplami układały się w trójkątną siatkę. Krople na tej powierzchni skrystalizowały ok. 70 K poniżej ich punktu krzepnięcia. Promieniowanie X pokazało, że te krople także skrystalizowały w formie i kierunku podobnych do kryształu, na którym osiadły.
(c) Kryształ krzemu przecięto tak jak w punkcie b, ale poddano specjalnej obróbce termicznej, która wywołała utworzenie pięciokątnego ułożenia atomów złota kontaktujących się z powierzchnią krzemu. Na tej powierzchni krople pozostały w metastabilnej fazie ciekłej aż do 120 K poniżej ich punktu krzepnięcia – były głęboko przechłodzone.
Zdjęcie dzięki uprzejmości Tobias Schülli
Eksperyment z przechłodzeniem
Umieść fabrycznie zamkniętą butelkę mineralnej wody niegazowanej w zamrażarce na 1–2 godziny. Po tym czasie woda powinna mieć od -10 do -5 °C. Ponieważ woda nie powinna mieć żadnych stałych zanieczyszczeń, powinna być ciekła nawet w tej temperaturze – jest przechłodzona.
Ostrożnie wyjmij butelkę z zamrażarki, a następnie uderz nią o stół lub rękę. Powinno być widać, jak woda zamarza, a powstawanie lodu przebiega bardzo szybko w całej butelce. Krystalizacja została wywołana przez falę uderzeniową wędrującą przez ciecz. (Fala uderzeniowa jest kolejnym wytłumaczeniem, dlaczego samoloty zostawiają za sobą widoczny ślad z kryształków wody).
Ten efekt można osiągnąć tylko w cieczach niezawierających zarodków, które mogłyby wywołać krystalizację. Jest to mało prawdopodobne w wodzie z kranu, która może zawierać krystaliczne zanieczyszczenia, wywołujące krystalizację bliżej punktu topnienia (zamarzania) wody.
Uwaga: nie zostawiaj butelki w zamrażarce zbyt długo, ponieważ woda w temp. poniżej -10 °C, zamarznie, nawet gdy nie ma w niej krystalicznych zanieczyszczeń.

References
- Fahrenheit DG (1724) Experimenta & observationes de congelatione aquæ in vacuo factæ. Philosophical Transactions 33: 78-84. doi: 10.1098/rstl.1724.0016
- Frank FC (1952) Supercooling of liquids. Proceedings of the Royal Society 215: 43-46. doi: 10.1098/rspa.1952.0194
- Greer AL (2010) Materials science: a cloak of liquidity. Nature 464: 1137-1138. doi: 10.1038/4641137a
- Ściągnij, darmowe artykuły lub zapisz się na listę Nature już teraz: www.nature.com/subscribe.
- Reichert H et al. (2000) Observation of five-fold local symmetry in liquid lead. Nature 408: 839-841. doi: 10.1038/35048537
- Ściągnij, darmowe artykuły lub zapisz się na listę Nature już teraz: www.nature.com/subscribe.
- Schülli TU et al. (2010) Substrate enhanced supercooling in AuSi eutectic droplets. Nature 464: 1174-1177. doi: 10.1038/nature08986
- Ściągnij, darmowe artykuły lub zapisz się na listę Nature już teraz: www.nature.com/subscribe.
- Turnbull D (1952) Kinetics of solidification of supercooled liquid mercury droplets. Journal of Chemical Physics 20: 411-424. doi: 10.1063/1.1700435
Web References
- w1 – CEA jest francuską Komisją Energii Atomowej i Alternatywnej (Commissariat à l’énergie atomique et aux énergies alternatives). Aby dowiedzieć się więcej, patrz: www.cea.fr
- w2 – Europejski Ośrodek Synchrotronu Atomowego (ESRF) jest międzynarodowym instytutem naukowym badającym fotony. ESRF jest członkiem EIROforum, wydawcy Science in School. Aby dowiedzieć się więcej, odwiedź:www.esrf.eu
Resources
- Aby uzyskać więcej informacji o chmurach, zobacz:
-
Ranero Celius K (2010) Clouds: puzzling pieces of climate. Science in School 17: 54-59. www.scienceinschool.org/2010/issue17/clouds
-
Institutions
Review
Jednym z najdziwniejdzych fenomenów natury jest fakt, że dla niektórych substancji punkt topnienia nie jest taki sam jak punkt zamarzania. W tym artykule Tobias Schülli wprowadza nas w świat skondensowanej materii: pokazuje różnice między stanami skupienia i dostarcza wyjaśnienia tej jawnej anomalii: przechłodzenia.
Tego artykułu można użyć w różny sposób jako pomocy naukowej. Nauczyciele mogą dać go uczniom do przeczytania, a następnie rozpocząć klasową dyskusję nie tylko o zmianach w stanach skupienia, ale także o współczesnych metodach badawczych na polu fizyki skondensowanej materii. Aby upewnić się, że uczniowie zrozumieli tekst, nauczyciel może zadawać pytania, np. o warunki wzrostu kryształów.
Ten artykuł może także zainspirować czytelników do pogłębiania wiedzy na temat przechłodzenia.
Co więcej, proste doświadczenie opisane w artykule może pokazać uczniom, że nie tylko temperatura decyduje o stanie skupienia materii.
Vangelis Koltsakis, Grecja





