Plásticos en automóbiles: polimerización e reciclaxe Teach article
Traducido por José Villanueva Santiago. Qué tipo de plásticos son empregados para fabricar un automóbil? ¿Cómo son sintetizados e reciclados? Marlene Rau e Peter Nentwig mostrán dúas actividades do proxecto “Chemie im Kontext”.

/ iStockphoto
A moitos rapaces gustánllelos automóbiles, estes conteñen gran variedade de plásticos: polímeros proveñentes de petróleo ou de materiais renovables. O interese polos automóbiles poder ser empregado para mostrarlles o tema dos plásticos e polímeros, por exemplo nunha unidade didáctica de química orgánica.
Leva os teus estudantes a mirar algúns automóbiles. ¿Qué coñecen nese momento sobor dos plásticos utilizados para fabricar automóbiles? ¿Qué lles gostaría atopar? Eles poden clasificar as súas ideas dacordo coas diferentes pezas dun auntomóbil (vexa Táboa 1, debaixo).
Táboa 1: O uso dos plásticos nos Automóbiles
- ¿Fan os plásticos o coche máis eco-eficiente? (diminución do consumo de combustible, reciclaxe das pezas de plástico)
- Faros transparentes e lanternas traseiras
- Rodas de inverno e verán
- Cinturóns de seguridade
- Plásticos termo-resistentes cercanos ó motor
- Escumas dos asentos dos automóviles
O punto importante é que os compoñentes dun automóbil teñen necesidades específicas (por exemplo, un cinto de seguridade ten que ser forte, pero flexible), o que significa que os seus constituíntes necesitan características específicas (por exemplo, o material non debe rachar), por iso, tipos específicos de material (por exemplo, tereftalato de polietileno) teñen que ser utilizados. Se os alumnos non se interesan con eses estímulos, habería que preguntarlles por qué un único tipo de plástico non sería suficiente para construír un automóbil.
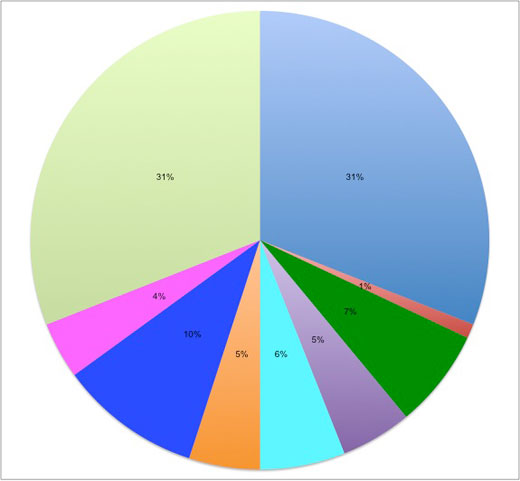
Terpolímero de Acronitrilo de butadieno-estireno: 31%
Tereftalato de polietileno: 1%
Policarbonato / polímero de acronitrilo-butadieno-estireno: 7%
Vidro acrílico: 7%
Polipropileno: 6%
Tereftalato de polibutileno: 5%
Poliacetato: 10%
Policarbonato: 4%
Poliamida: 31%
Imaxe cortesía do Leibniz Institute for Science and Mathematics Education (Instituto Leibniz de Ciencias e Educación Matemática)
As actividades neste artigo contemplan dous dos temas reflectidos na Táboa 1: reciclalos plásticos usados nos automóbiles. Cada actividade consiste nunha folla de traballo e información recollida. As actividades forman parte dun longo plan de clases (ver cadro) axeitado para alumnos con idades superiores ós 16 años, que deben traballar en grupos de dous ou tres membros. Propón unha ou dúas clases de 45 minutos para cada actividade.
O proxecto “Chemistry in context” (Química en contexto)
‘Chemie im Kontext’ (‘Chemistry in context (Química en contexto)’) é un proxecto coordinado polo Leibniz Institute for Science and Mathematics Education (Instituto Leibniz de Ciencias e Educación Matemática) da University of Kiel (Universidade de Kiel), en Alemaña. Entre 2002 e 2008, profesores de química, outros educadores das rama das ciencias e representantes das autoridades da escola desenvolveron unidades de didácticas de química, para todos os graos e tipos de escolas, conectando os requisitos curriculares coas situacións cotiás. Exemplos de recursos e recomendacións para o desenvolvemento de materiais adicionais están dispoñibles en liñaw1. Pódese solicitar de balde un conxunto de recursos producidos polos profesores, e catro dos plans de clase están dispoñibles gratuitamente en liña (todos en alemán). Un libro e unha guía do profesor (en alemán) son publicadas pola Cornelsen Verlag.
Este artigo é un extracto dun dos plans de clase. O plan de clase completo inclúe seis actividades diferentes, un para cada unha das celas da Táboa 1.
Polimerización: plástico para as luces do automóbil

Imaxe cedida pola BASF 1998
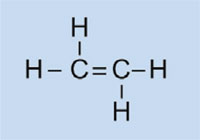
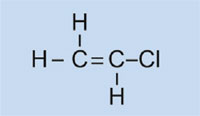
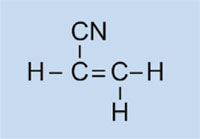
As luces do automóbil están cubertas por tapas de plástico para mantelas limpas e secas, e, nalgúns casos, para conferirlle unha cor (vermello, por exemplo, para as luces traseiras e laranxa para os indicadores). O material utilizado debe ser transparente, a luz, plausible, facilmente moldeable e razoablemente forte. Nesta actividade, imos sintetizar o plástico usado, polimetacrilato de metilo ou PMMA.
O polimetacrilato de metilo é comunmente coñecido como vidro acrílico ou plexiglass, e pertence ó grupo de plásticos chamados polimerizados. A súa característica común é que as súas unidades monoméricas básicas unidades conteñen un ou máis enlaces dobres. Baixo a influencia de radicais (moléculas con un electrón non emparellado libre), estas unidades sofren polimerización radical que produce macromoléculas de cadea longa.
As características da macromolécula dependen de que cadeas laterais posúen, que á súa vez dependen do monómero utilizado. Usando monómeros diferentes na formación de plásticos polimerizados, podemos crear plásticos para diversas aplicacións en automóbiles. Por exemplo, as cadeas laterais voluminosas da PMMA evitan que o plástico forme estruturas cristalinas cando se solidifica, o que refractaría a luz. Pola contra, tales plásticos amorfos son transparentes, o que os fai útiles para substitutos do vidro: son máis lixeiros, máis maleables e menos propensos a ruptura.
Podemos ilustrar la polimerización radical cun tanque de combustible do automóbil, o cal está feito de polieteno. O polieteno está feito a partir de eteno (etileno, C2H4) os monómeros, nunha reacción iniciada polo peróxido de dibenzoílo. Cando se quenta a 90 °C, o peróxido de dibenzoílo divídese en dous radicais. Se un deses radicais se une a unha molécula de eteno, rompe o dobre enlace da molécula de eteno e fórmase un novo radical maior. Deste xeito, comeza unha reacción en cadea, que só se detén cando dous radicais reaccionan un co outro.
|
Monómero |
Polímero |
|---|---|
|
Eteno
|
Polietileno
|
|
Propeno
|
Prolipropileno
|
|
Cloruro de vinilo
|
Cloruro de polivinilo
|
|
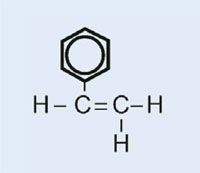
Estireno
|
Poliestireno
|
|
Acrilonitrilo
|
Poliacronitrilo
|
|
Éster metílicos do ácido metacrílico
|
Polimetacrilato de metilo
|
|
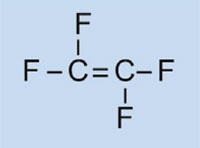
Tetrafluoroetileno
|
Politetrafluoroetileno
|


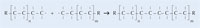
Figura 2: As etapas implicadas na polimerización
Imaxes cortesía do Leibniz Institute for Science and Mathematics Education (Instituto Leibniz de Ciencias e Educación Matemática)
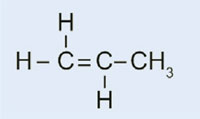
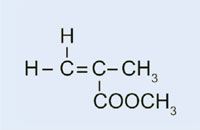
No noso experimento, usaremos o peróxido de dibenzoílo para iniciar un proceso semellante: en vez de usar eteno para formar polieteno, usaremos 2-metilpropanoato de metilo para xerar polimetacrilato de metilo.
Folla de traballo do estudante 1: sintese dun polímero transparente
Materiais

Imaxe cortesía do Leibniz
Institute for Science and
Mathematics Education
(Instituto Leibniz de Ciencias e
Educación Matemática)
- 2-metilpropanoato de metilo (tamén coñecido como metilmetacrilato; C5H8O2)
- Peróxido de dibenzoílo (C14H10O4)
- Colorante Vermello Sudán
- Auga
- Acetona (propanona, C3H6O)
Material por grupo
- Unha balanza de precisión
- Unha placa calefactora
- Un tubo de ensaio
- Un vaso de precipitados
- Un vidro de reloxo
- Unha espátula
- Unha pipeta
- Unha cápsula de alumnio
Nota de seguridade
Use luvas, lentes de seguridade e traballe baixo unha campá extractora. O 2-metilpropanoato de metilo, o peróxido de dibenzoílo e acetona son inflamables, a acetona tamén é irritante. Os tres deben ser usados con coidado. Os residuos de Vermello Sudan non deben ser eliminados polo sumidoiro.
Vexa tamén a nota xeral de seguridade.
para comezar o experimento
Imaxe cortesía do Leibniz
Institute for Science and
Mathematics Education
(Instituto Leibniz de Ciencias e
Educación Matemática)
Procedemento
- Pesar 0,2 g de peróxido de dibenzoílo no tubo de ensaio
- Engadir 10 ml de 2-metilpropanoato de metilo.
- Para colorear o plástico resultante, engada un pouco Vermello Sudan (o suficiente para cubrir a punta da espátula).
- Poñer o tubo nun vaso cheo de auga a 90ºC e poñelo conxunta na placa de calefacción, ver Figura 3, debaixo.
A reacción terá lugar durante uns 20 minutos, tras o que a mestura debe ser visiblemente viscosa. Nese medio tempo, lea a información baixo o título ‘polimerización: plástico para luces do coche’ e comprenda o mecanismo de reacción para a polimerización radical do 2-metilpropanoato de metilo.
- Verta a solución na cápsula de alumnio.
Se o plástico comeza a solidificar no tubo de ensaio, pode disolvelo de novo con acetona. Pode entón continuar o experimento descrito, posuíndo máis tempo para que a acetona evapore.
- Cobra a cápsula de aluminio co vidro de reloxo para manter quente o plástico e deixe endurecer o máis rápido posible.
- Deixe o polimetacrilato de metilo solidificar durante 24 h, a continuación, sáqueo do soporte de aluminio.
¿Cómo comprobar as propiedades do seu plástico e comparalas coas de vidro?
Reciclaxe de plásticos proveñentes dos automóbiles

de diferentes combustibles;
de esquerda a dereita: o
aceite de calefacción;
residuos de plástico como as
olefinas, lignito. Prema na
imaxe para ampliar
Imaxe cortesía do Leibniz
Institute for Science and
Mathematics Education
(Instituto Leibniz de Ciencias e
Educación Matemática)
Nesta actividade, os alumnos primeiro aprenden como os plásticos dos automóbiles poden ser reciclados, a continuación, proban coas súas mans a reciclaxe: transformar unha botella de plástico nun anaco de plástico con forma.
¿Qué ocorre cando temos que esganar un automóbil? Podemos pensar en moreas de automóbiles oxidados e pneumáticos vellos, destinados a recheos, pero en realidade moitas das pezas do coche son recicladas para recuperar materiais valiosos, especialmente metais.
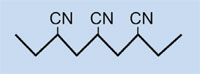
Os plásticos dun automóbil tamén poden ser reciclados, de tres xeitos: como pezas, compoñentes químicos ou combustible.
- Os automóbiles poden ser reparados usando vellas pezas de plástico tales como parachoques. Con todo, como as pezas están vellas, cambian as súas características, converténdose os inadecuadas para reutilización: A radiación solar, por exemplo, fai que a maioría dos plásticos aumenten a súa fraxilidade. Afortunadamente, algunhas partes de plástico poden ser fundidas e remodeladas en artigos para o que os requisitos de calidade son máis baixos, como postes ou bancos de xardín.
- Empragando procesos químicos, algúns polímeros poden ser divididos nos seus compoñentes monoméricos, que están, entón, dispoñibles para novas sínteses. Os plásticos poden ser usados para producir outros recursos para a industria química, por exemplo, unha tonelada de certos tipos de plástico utilizados dá uns 600 kg de metanol, que é un recurso importante para a industria de plásticos e tamén é utilizado en células de combustible para obter enerxía .
- Os plásticos triturados poden ser usados directamente como combustible, substituíndo o carbón, por exemplo, plantas que obteñen a enerxía a partires do lixo. Eles tamén poden substituír o coque utilizado para a produción de ferro en fornos metalúrxicos (ver Figura 4).
Folla de traballo do estudante 2: reciclaxe de plásticos na clase
Nesta actividade, vai reciclar residuos de plástico procedentes dunha botella en anacos de plástico moldeados. O que se fabrica desta forma só está limitado pola súa imaxinación: chaveiros, colgantes, enfeites de árbore de Nadal.

Imaxe cortesía de hippokrat /
iStockphoto
Materiais por grupo
- Un queimador de Bunsen
- Un trípode cunha malla de arame
- Moldes cortadores de galletas de diferentes formas
- Follas de aluminio
- Un coitelo
- Os residuos de plástico (preferiblemente botellas de PEt de auga mineral)
- Unha selección de colorantes
Nota de seguridade
Use lentes de seguridade e traballe nunha campá extractora. Non permita que a chama se poña en contacto directo co plástico. Teña coidado de non cortarse.
Vexa tamén a nota xeral de seguridade.
Procedemento
- Use a coitelo para triturar os residuos de plástico en anacos tan pequenos como lle sexa posible.
- Cubra o fondo e os lados dos moldes cortadores de biscoito con papel aluminio e énchaos a unha profundidade de aproximadamente 0,5 cm, con residuos de plástico de triturado. Se o desexa, probe a engadir unha pequena cantidade de colorante ós residuos de plástico.
- Poña os moldes cortadores sobre a malla de arame por enriba do pico de Bunsen e quénteos lentamente, ata que o plástico se derreta.
- Unha vez que teña arrefecido, elimine o plástico e o papel aluminio.
Compare as características do plástico antes e despois da reciclaxe. ¿Qué conclusión se pode sacar sobre a reciclaxe de plástico?
No seu grupo, discuta os tres métodos de reciclaxe descritos baixo o título ‘Reciclaxe de plásticos proveñentes dos automóbiles’ e compare as posibles aplicacións. Reflexione sobre a experiencia de realizada: ¿Cáles son as posibles aplicacións do plástico?
Estudo dos plásticos con Raios X

No European Synchrotron radiation Facility (Laboratorio Europeo de Radiación con Sincotrón) (ESRF)w2, fibras de alto rendemento, tales como o plástico Kevlar® foron estudados por máis dunha década. Cinco veces máis forte que o aceiro, en termos de peso, O Kevlar® é usado en pneumáticos de bicicleta e armaduras corporais, velas para veleiros de competición e cables de amarre.
Moito do traballo de ESRF sobre fibras de alto rendemento implica a determinación da morfoloxía exterior-interior: as diferenzas de estrutura entre as capas máis externas da fibra e o seu núcleo. Estas diferenzas poden influenciar as propiedades mecánicas da fibra, polo que o entendemento da morfoloxía do exterior-interior pode permitir adaptar as propiedades das fibras durante o proceso de fabricación.
A microscopía ESRF de raios X e usadarutineiramente para novos estudos destes notables materiais, tanto para a investigación académica como para a industrial. Isto é porque outras técnicas non fornecen información semellante, sen corte da fibra e, potencialmente cambiando a súa microestrutura interna. Para máis información, consulte Capellas Espuny, 2009.
ESRF é membro de EIROforumw3, editor da Science in School (Ciencia na Escola).
References
- Capellas Espuny M (2009) A new look into fibre-reinforced composite Materiais. ESRF News 50: 12-13. www.esrf.eu/UsersAndScience/Publications/Newsletter
Web References
- w1 – Para saber máis sobre o proxecto (en inglés e alemán) e baixar os recursos (en alemán), consulte a páxina web Chemie im Kontext: www.chik.de
- w2 – Un centro internacional de investigación en Grenoble, Francia, ESRF produce pulsos de raios X de elevado brillo, ó utilizan miles de científicos de todo o mundo cada ano. Para máis información, consulte: www.esrf.eu
- w3 – Para saber máis sobre EIROforum, consulte: www.eiroforum.org
Resources
- Para saber máis sobre o proxecto ‘Chemie im Kontext’ olle:
-
Parchmann I et al. (2006) Chemie im Kontext: a symbiotic implementation of a context-based teaching and learning approach. International Journal of Science Education 28(9): 1041-1062
-
Nentwig P et al. (2007) Chemie im Kontext: situated learning in relevant contexts while systematically developing basic chemical concepts. Journal of Chemical Education 84: 1439
-
- Para ollar unha representación sobre a polimerización radical de eteno a polietileno na clase, olle en:
-
Sturm B (2009) The drama of science. Science in School 13: 29-33.
-
- Para saber máis sobre a investigación na biodegradación de plásticos, olle:
-
Bradley D (2007) Plastics, naturally. Science in School 5: 66-69.
-
Review
A química é xeralmente vista polos estudantes como distante e perigosa, pero estamos rodeados por ela e ela ten un papel importante na mellora da nosa calidade de vida. Actividades como as descritas neste artigo, que utilizan materiais d avida cotiá, pode axudar a aumentar o recoñecemento público da química e fomentar o interese nela entre os estudantes.
Estas actividades poden ser usadas en clases de química orgánica e tamén na bioloxía, para discutir a importancia da reciclaxe. Aínda que os autores suxiren as actividades para os alumnos con máis de 16 anos, tamén poderían ser usadas con alumnos máis novos ( a aprtires dos 14 anos).
Mireia Guell Serra, España