Bernstein als Einführung in die organische Chemie Teach article
Übersetzt von Bernhard Sturm. Wussten Sie, dass das Elektron und die Elektrizität nach Bernstein benannt sind, dem “Gold der Ostsee”? Bernhard Sturms Unterrichtseinheit, die nicht nur in die Leitfähigkeit, sondern auch einige andere Eigenschaften von organischen Feststoffen einführt,…
Einführung

Mit freundlicher Genehmigung
von Steev Selby; Bildquelle:
Wikimedia Commons
Bernstein wurde vor Tausenden von Jahren als Schmuck benutzt, als Zusatz von Parfümen und in der Volksmedizin. Er hat aber auch seinen Platz in der Wissenschaft. Er war das erste Material, an dem der griechische Philosoph Thales von Milet 600 Jahre v. Chr. elektrostatische Phänomene beobachtete. Zudem gab er der Elektrizität ihren Namen: Im Jahr 1601 prägte der englische Physiker William Gilbert, der als erster zwischen magnetischer und elektrischer Anziehung unterschied, den Ausdruck „electricus“, abgeleitet vom griechischen Namen elektron (deutsch: glänzend), für die Eigenschaft von Körpern, kleine Objekte nach dem Reiben anzuziehen.
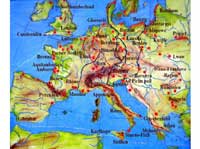
Europa. Bernsteinfundorte in
Rot, historische
Bernsteinrouten in Schwarz,
Flüsse in Blau. Zum
Vergrößern auf das Bild
klicken
Mit freundlicher Genehmigung
von Johannes Richter;
Bildquelle: Wikimedia
Commons
Bernstein ist ein Pflanzenharz, das entweder in der Pflanze selbst oder aber nach dem Herausfließen versteinert. Bernsteine können 20 bis 320 Millionen Jahre alt sein. Eine genaue Altersbestimmung ist jedoch schwierig, da die Radiocarbon-Methode nur für Proben bis zu einem Alter von 50.000 Jahren angewendet werden kann. Das Alter des den Bernstein umgebenden Bodens muss deshalb bestimmt werden, was zu Fehlbestimmungen führen kann, da der Bernstein weit entfernt von der Stelle stammen kann, an der er entdeckt wurde. Auch wenn Bernstein überall auf der Erde gefunden wird, einschließlich der Dominikanischen Republik, wo blauer Bernstein abgebaut wird, liegen die vermutlich bekanntesten und ergiebigsten Vorkommen in der europäischen Ostsee. Bernsteine werden durch Wellen vom Seeboden angehoben und per Hand gesammelt, erbaggert oder ertaucht. An Land wird Bernstein über oder unter Tage abgebaut.
Die heterogenen, gelb- bis rotfarbenen Makromoleküle versteinern aus zwei Arten von weichklebrigen Pflanzenharzen: terpenoiden oder phenolischen Harzen. Terpenharze, produziert von Nadelbäumen und Bedecktsamern (Blütenpflanzen), bestehen aus ringförmigen Strukturen, die aus Isopren-Einheiten geformt wurden. Phenolharze werden nur in Blütenpflanzen gefunden und enthalten Lignine, Flavonoide und bestimmte Pigmente.

Bernstein, 25-40 Millionen
Jahre alt
Public Domain Bild; Bildquelle:
Wikimedia Commons
Harze schützen verletzte Pflanzen vor weiterer Beschädigung, indem sie ausströmen und sich erhärten. Dadurch bilden sie eine Abwehrschicht gegenüber potenziell eindringenden Pilzen und Insekten. Die flüchtigen Fraktionen der Harze duften (denken Sie an den typischen Geruch von Kiefernharz), aber es ist der klebrige, nicht-flüchtige, di- (C20) und tri-terpenoide (C30) Anteil, der in radikalischer Polymerisierung zu Bernstein fossiliert. Während des Millionen von Jahren dauernden Entstehungsprozesses finden neben Polymerisierungen außerdem Isomerisierungen, Quervernetzungen und Ringbildungen statt, die zu einer Mischsubstanz mit der durchschnittlichen Summenformel C10H16O führen. Auch ein geringer Anteil von Schwefel (bis zu 1%) ist meist enthalten.
Weil Bernstein viele klassische Eigenschaften von organischen Stoffen besitzt, wie z.B. brennbar zu sein, Elektronen nicht zu leiten, aber elektrostatisch aufladbar zu sein, ist es ein gut geeigneter Stoff, um diese Verbindungsart modellhaft einzuführen, auch wenn er unterschiedlich und komplex zusammengesetzt ist. Dies eröffnet die Möglichkeit, Chemie erweitert in einen Kontext mit Kunst, Biologie, Geowissenschaften und Physik zu setzen, und es werden auch Schüler angesprochen, die normalerweise nicht an diesem Fach interessiert sind.
Diese 5-stündige Unterrichtseinheit eignet sich für Schüler ab dem 10. Schuljahr, denen die Dichte, die Leitfähigkeit und der Stromkreis bereits bekannt sind. Sie können den Schülern Lehrbücher vorausgehender Klassenstufen zur Verfügung stellen, mit denen diese ihr Wissen auffrischen können. Die Unterrichtseinheit besteht aus fünf Hauptaktivitäten: In vier Stunden von je 45 Minuten rotieren Schülergruppen durch die Stationen, sodass jede Gruppe alle Versuche durchführt. Die einzelnen Stationen dauern je etwa 20 Minuten. In einer großen Klasse kann es sinnvoll sein, die Stationen doppelt vorzubereiten. In der letzten Unterrichtsstunde präsentieren die Schüler ihre Ergebnisse.

Bernstein wie diese sind sehr
gut für die Experimente
geeignet
Mit freundlicher Genehmigung
von Bernhard Sturm
Die Unterrichtseinheit kann mit zusätzlichen optionalen Übungen ergänzt werden (siehe unten), bei denen Kollegen anderer Fächer einbezogen werden können. Alternativ können Sie alle oder einen Teil der Versuche in Demonstrationen oder parallel mit der ganzen Klasse durchführen. Die angewendeten Methoden in den einzelnen Stationen variieren, und an die Ergebnisse können sich die Schüler leicht erinnern.
Der für diese Stationsarbeit benötigte Bernstein kann über Online-Shops einfach bezogen werden. Eine 30-35 cm lange “Zahnungskette” für Babys, erhältlich für etwa 8-20 €, reicht aus, um alle Aktivitäten mit etwa 30 Schülern durchzuführen. Oftmals sind Schüler so begeistert, dass sie Familienschmuck von zu Hause mitbringen. Das einzige Experiment, dass Bernstein verbraucht oder beschädigt, ist dessen Verbrennung.
Hauptaktivitäten
Für diejenigen Schüler, die besonders schnell sind, können Sie weitere organische Stoffe zur Verfügung stellen, mit denen diese die gleichen Experimente durchführen und mit Bernstein vergleichen können. Dies können sein: für Experiment 2 andere nicht-gesättigte organische Substanzen wie Alkane, z.B. die gelb leuchtende Flamme eines Gasbrenners und eines Feuerzeugs; für Experiment 3 bis 6 Kunststoffe wie Polyvinylchlorid und Polyethylen, aber auch verschiedene Arten von Holz (z.B. Kiefern- und Eichenholz aus einem Dichtewürfel-Set) und Kolophonium (Geigenharz mit dem die Bogenhaare eingerieben werden).
1) Geologischer Ursprung
Die Schüler sollen die Zeit und den Prozess der natürlichen Bildung von Bernstein, Rohöl und Kohle in Internet- und Literaturrecherchen vergleichen. Sie bewerten dabei kritisch die Verlässlichkeit der Informationen aus unterschiedlichen Quellen, indem sie die Daten und Entstehungsprozesse schriftlich festhalten. Für die Webseiten notieren sie die Daten des Zugriffs. Ein Beispiel für mögliche Angaben findet sich in Tabelle 1.
| Quelle der Information | |||
|---|---|---|---|
| dtv-Lexikon, München, 1966 | http://en.wikipedia.org Zugriff vom 31.03.2011 | ||
| Erdöl | Entstehungszeit | Kreidezeit, vor 145-65 Millionen Jahren | vor Millionen von Jahren |
| Bildung | Kleinstlebewesen sanken zum Meeresboden und formten Sapropel (organischen Faulschlamm); sie wurden im Sediment unter anaeroben Bedingungen und hohem Druck versetzt | Große Mengen von prähistorischem Zooplankton und Algen fielen unter sauerstoffarmen Bedingungen auf den Boden eines Wasserkörpers; die organische Materie mischte sich mit Schlamm und wurde unter dem Sediment begraben; Hitze und Druck führten zur Bildung von Erdöl. | |
| Kohle | Entstehungszeit | Karbon, vor 360-300 Millionen Jahren | Karbon, vor 359-299 Millionen Jahren |
| Bildung | Abgestorbene tropische Pflanzen sanken in den Schlamm, wo sie mit Sand und Lehm bedeckt wurden; hoher Druck und anaerobe Bedingungen führten zur Karbonisierung. | Schichten von Pflanzenmaterie sammelten sich auf dem Boden eines Wasserkörpers; Schlamm oder saures Wasser schützte sie vor biologischer Zersetzung und Oxidation; sie wurden von Sediment bedeckt und wandelten sich in Kohle um. | |
| Bernstein | Entstehungszeit | Devon bis Tertiär, vor 400 bis 40 Millionen Jahren | Jüngeres Karbon (vor 320 Millionen Jahren) und später |
| Bildung | Harz floss aus Bäumen zum Boden, sank nach einem Klimawechsel unter die Seeoberfläche und polymerisierte unter anaerobischen Bedingungen. | Harz, das sich entweder noch in der Pflanze befand oder ausgeflossen war, tropfte auf den Boden und schloss dabei oftmals Verunreinigungen ein; hohe Temperaturen und Drücke aufgrund von Überdeckung mit Sedimentschichten führten zunächst zur Bildung von Kopal (Zwischenstufe der Polymerisierung und Aushärtung, zwischen „klebrigen“ Harzen und Bernstein); andauernde Hitze und ständiger Druck trieb die Terpene aus, was zur Bernsteinbildung führte. | |
2) Verbrennung
Machen Sie Ihre Schüler darauf aufmerksam, dass hohe Kohlenstoffanteile in einer brennenden organischen Substanz zu einer rußenden Flamme führen. Die Schüler sollen dann ein Stück Bernstein (deutsch: Bernstein = Börnsteen = brennender Stein) mit einer Tiegelzange unter ein Reagenzglas halten, den Bernstein mit einem Streichholz entzünden und den sich am Reagenzglas anlagernden Ruß beobachten.
Um den Versuch mit dem Thema der Feinstaubpartikel aus Dieselmotoren zu verbinden, können die Schüler die Verbrennungsbedingungen eines Bunsenbrenners durch das Öffnen und Schließen der Luftzufuhr variieren und diskutieren, wie man den entstehenden Ruß vermeiden kann.
Sicherheitshinweis
Es müssen Sicherheitsbrillen getragen werden, und das Glas darf nicht überhitzt werden, da es ansonsten zersplittern kann. Polyvinylchlorid (mögliches optionales Material für die Versuche 3 bis 6) darf nicht verbrannt werden, da hierbei gefährliche Dioxine entstehen können. Sehen Sie hierzu auch den allgemeinen Sicherheitsvermerk von Science in School.

Mit freundlicher Genehmigung von Bernhard Sturm

und Feuerstein (auf der
Waage) können mithilfe ihrer
Dichte unterschieden werden.
Zum Vergrößern auf das Bild
klicken
Mit freundlicher Genehmigung
von Bernhard Sturm
3) Dichte
Die Schüler sollen die Dichte von Bernstein (1,050–1,096 g/ml) bestimmen, die etwas höher als diejenige von Wasser (etwa 0,998 g/ml bei Raumtemperatur) ist. In diesem Experiment werden die exaktesten Ergebnisse erzielt, wenn größere Bernsteine ohne Loch benutzt werden. Ich besitze ein großes Bernsteinstück und einen Feuerstein vergleichbarer Größe. Üblicherweise gebe ich meinen Schülern beide Steine und bitte sie über die Dichtebestimmung zu ermitteln, welcher der beiden welcher ist.
Es wird ein Stück Bernstein, ein Messzylinder, Wasser (mit einem kleinen Tropfen Spülmittel, um die Oberflächenspannung zu verringern und die Messgenauigkeit zu erhöhen) und eine Waage benötigt.
Der Bernstein wird gewogen. Der Messzylinder wird teilweise mit Wasser gefüllt und das Wasservolumen notiert. Nach dem Hineingeben des Bernsteins wird das abgelesene Volumen notiert. Die Dichte des Bernsteins wird berechnet nach:
Dichte des Bernsteins [g/ml] = Masse des Bernsteins [g] / (Volumen mit dem Bernstein [ml] – Volumen ohne den Bernstein [ml])
Viele organische Verbindungen haben Dichten nahe der des Wassers (0,8–1,2 g/ml). Polyvinylchlorid ist mit einer Dichte von 1,4 g/ml untypisch, weil es schwerere Chloratome enthält.
4) Abtrennung von Bernstein aus einer Mischung organischer und anorganischer Stoffe
Die Schüler lernen, wie sie Bernstein von Gestein und Sand abtrennen können; ein Versuch mit praktischer Relevanz für den Bernsteinabbau.
- Wiege das leere Becherglas.
- Füge ein definiertes Volumen Wasser zu und wiege nochmals, um die Masse des Wassers zu bestimmen.
- Füge als nächstes die Mischung von Sand, Gestein und Bernstein hinzu und wiege das Becherglas nochmals. Notiere hierbei das erhaltene Volumen.
- Füge nach und nach Salz hinzu bis der Bernstein aufschwimmt. Wiege das gesamte Becherglas nochmals und notiere das erhaltene Volumen.
Wie groß ist die Dichte des Salzwassers? Berechne sie nach:
Dichte des Salzwassers [g/l] = [(Masse des Becherglases zum Versuchsende (Schritt 4) – Masse des Becherglases bevor Salz hinzugefügt wird (Schritt 3)) + (Masse des Becherglases mit Wasser (Schritt 2) – Masse des leeren Becherglases (Schritt 1))] / [Volumen des Wassers + (Volumen des Becherglases zum Versuchsende (Schritt 4) – Volumen des Becherglases ohne Salz (Schritt 3))]
Diese sollte natürlich höher sein (>1,1 g/ml) als die im Experiment 3 bestimmte Dichte, da der Bernstein ansonsten nicht aufschwimmen würde.
Die Schüler sollen einen eigenen Entwurf zeichnen, wie diese Methode für eine Fördertechnik zum kontinuierlichen Abbau von Bernstein genutzt werden kann (siehe Grafik unten).
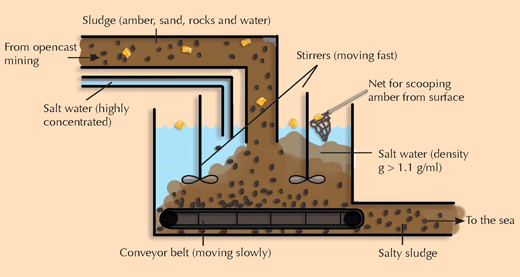
Mit freundlicher Genehmigung von Bernhard Sturm und Nicola Graf
5) Leitfähigkeit
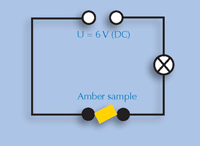
von Bernhard Sturm
Die Schüler lernen, dass organische Feststoffe keine Elektronen leiten. Sie bauen dazu einen elektrischen Stromkreis mit einer Spannungsquelle, drei Kabeln und einer Glühlampe auf und testen mit ihm die Leitfähigkeit von Bernstein. Wenn sie mit dem experimentellen Aufbau nicht vertraut sind, können Sie ein Physiklehrbuch bereitstellen, in dem sie diesen nachschauen können.
6) Ladungstrennung
Die Schüler werden mit der elektrostatischen Induktion und der Ladungstrennung vertraut gemacht, indem sie Gilbert´s elektrostatisches Experiment durchführen: Sie reiben ein Stück Bernstein an Wolle und stellen fest, dass er kleine Stücke von Papier oder z.B. getrocknetes Holundermark (Sambucus spp.) anzieht. Dieses klappt auch gut mit Bernsteinen einer Babykette.
Das Experiment funktioniert nicht besonders gut, wenn die Luft feucht ist, weil das Wasser in der Luft elektrisch leitet und die Aufladung des Bernsteins reduziert. Feuchte Finger haben den gleichen Effekt. Um bessere Ergebnisse zu erzielen, können die Schüler isolierende (Plastik-)Pinzetten zum Halten des Bernsteins benutzen.
Zusatzaktivitäten

Mit freundlicher Genehmigung
von V Girard / D Néraudeau,
UMR CNRS 6118
Schmuckherstellung
Um das Fach Kunst mit der Chemie zu verknüpfen und die manuellen Fähigkeiten der Schüler zu fördern, kann man sie ihren eigenen Schmuck basteln lassen. Dazu benötigen sie Rohbernsteine von mindestens 15 mm Durchmesser. Der Bernstein wird mit feuchtem feinem Schleifpapier (Körnungsangabe nach dem Coated Abrasive Manufacturing Institute: 120 bis 1000) geschmirgelt und danach mit Zahncreme poliert. Man spült ihn anschließend mit Wasser ab, trocknet ihn mit Küchenpapier und reibt ihn mit einem in Pflanzenöl getränkten Stofftuch ein. Dann wird der Bernstein mit einer heißen Nadel durchstoßen (dies sollte durch den Lehrer geschehen) oder ein 1-2 mm dickes Loch hineingebohrt. Man kann den Bernstein auf einem Nylon- oder Lederband zu einer Hand- oder Halskette auffädeln.
Verbindungen zur Biologie
Zur Verknüpfung mit dem Fach Biologie können die Schüler Inklusen betrachten oder vertieft über Harze diskutieren – welche Zusammensetzung haben sie, wo treten sie auf, welche Funktion haben sie und welche Struktur hat Holz?
Klassifizierung von Bernstein
Pflanzenharze sind so unterschiedlich, dass die verschiedenen chemischen Zusammensetzungen zur Identifizierung, von welcher Pflanzenart der Bernstein gebildet wurde, genutzt werden können. Dies bedeutet aber nicht zwingend, dass ähnliche Harze von ähnlichen Pflanzen stammen müssen. So haben neue Forschungen gezeigt, dass Harze von sehr ähnlicher molekularer Zusammensetzung von gänzlich unterschiedlichen Pflanzen produziert werden können (Bray & Anderson, 2009) – die Unterschiede können sehr gering sein. Auf der Grundlage ihrer chemischen Bestandteile kann Bernstein in fünf grobe Klassen eingeteilt werden:
- Klasse I: die am häufigsten auftretende, enthält Labdatriencarbonsäuren; drei Unterklassen
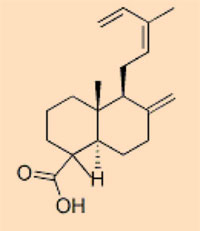
- Klasse II: geformt aus Harzen mit einer Sesquiterpenbase, wie z.B. Cadinen
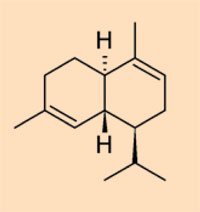
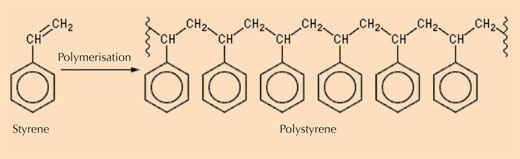
- Klasse III: natürliche Polystyrole
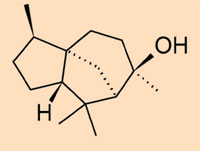
- Klasse IV: eine Gruppe von nicht-polymerisierten Bernsteinen, die hauptsächlich aus vom Cedran abgeleiteten Sesquiterpenen aufgebaut sind
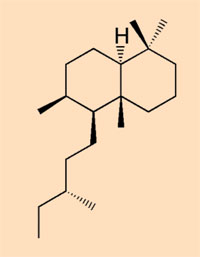
- Klasse V: von Kiefern oder Kieferverwandten produziert; eine Mischung von diterpenoiden Harzen mit n-Alkylanteilen (R-NH-CH3)
Public Domain Bilder; Bildquelle: Wikimedia Commons; bearbeitet von Nicola Graf
Bernsteinforschung am ESRF

Bernsteine sind eine ergiebige Quelle für fossile Zeugen. Am European Synchrotron Radiation Faciliy (ESRF)w1in Grenoble, Frankreich, wird energiereiche Röntgenstrahlung genutzt, um Bernsteininklusen zu untersuchen. Dies ist besonders bei undurchsichtigen Bernsteinstücken hilfreich, die für Paläontologen mit klassischen Mikroskopiertechniken unzugänglich sind. Mehrere hundert Tierinklusen aus der mittleren Kreidezeit, 100 Millionen Jahre alt, wurden identifiziert.
In einer anderen Studie am ESRF nutzten Forscher die gleiche Technik, um 3-dimensionale Bilder von in Bernstein eingeschlossenen Federn zu gewinnen, die zu gefederten Dinosauriern gehört haben könnten – einer Zwischenstufe in der Evolution moderner Vögel.
Für weitere Informationen lesen Sie den Online-Reportw2des ESRF, eines Mitglied des EIROforums, des Herausgebers von Science in School.
References
- Bray PS, Anderson KB (2009) Identification of carboniferous (320 million years old) class Ic amber. Science 326(5949): 132-134. doi: 10.1126/science.1177539
-
Der vollständige Text ist abrufbar unter: www.sciencemag.org/content/326/5949/132.short
-
- Zu Methoden des darstellenden Spiel im Chemie- und Physikunterricht, einschließlich eines Beispiels zur radikalischen Polymerisierung von Ethen zu Polyethylen siehe:
-
Sturm B (2009) Darstellendes Spiel in den Naturwissenschaften. Science in School 13: 29-33.
-
Web References
- w1 – Zur weiteren Information über das ESRF siehe: www.esrf.eu
- w2 – Wissenschaftler am ESRF haben energiereiche Röntgenstrahlung genutzt, um Bernsteiniklusen zu untersuchen. Siehe: www.esrf.eu/news/general/amber
Resources
-
Zum Herunterladen von Tafeln zur Erdgeschichte siehe: www.stratigraphy.org/upload/ISChart2009.pdf oder www.chronos.org/downloads/timetowerparis_highres.png
-
Um etwas über die Forschung zu biologisch abbaubaren Kunststoffen zu erfahren siehe:
-
Bradley D (2007) Plastics, naturally. Science in School 5: 66-69.
-
Institutions
Review
Bernhard Sturm, der bereits einen anderen sehr interessanten Artikel in Science in School (Sturm, 2009) veröffentlicht hat, ist ein Beispiel für Kreativität im Bereich des naturwissenschaftlichen Unterrichtens.
Diejenigen, die denken, dass Chemie und Physik langweilige Fächer sind, sollten die Experimente zum Bernstein ausprobieren, die der Autor vorstellt. Ausgehend von diesem uralten Material und den vorgeschlagenen Links kann man als naturwissenschaftlicher Lehrer verschiedene Themen bearbeiten, die mit dem Bernstein verbunden sind und dabei unerwartete Beziehungen zur Kunst und den Geisteswissenschaften entdecken.
Die Hauptversuche eröffnen in der Tat die Möglichkeit, organische Chemie (natürliche und künstliche Polymere), Geowissenschaften (Sedimentgesteine, Fossilien, fossile Brennstoffe), Physik (Dichte, Trennmethoden, Leitfähigkeit), Umweltwissenschaften (Verbrennung, Verschmutzung) und Biologie (Pflanzenharze, Bernsteininklusen) anzusprechen.
Für diejenigen, die an interdisziplinären Verknüpfungen interessiert sind, ist die Auswahl ebenfalls groß: Kunst und Handwerk (Schmuckherstellung), Geschichte (Bernsteinstraße, Bernsteinzimmer) oder Wirtschaft (Bernsteinabbau und Handel), um nur einige zu nennen.
Letztendlich benötigt man als Lehrer nur ein paar Stücke des „Goldes der Ostsee“ (die – glücklicherweise – viel günstiger sind als echtes Gold), um Bernhard Sturm auf den Fußstapfen von Thales von Milet und William Gilbert und anderen zu folgen.
Das Lesen des Artikels kann für den Besuch eines naturhistorischen oder Wissenschaftsmuseums als wertvoller Hintergrund dienen und auch für Verstehensaufgaben genutzt werden. Mögliche Fragen wären:
- Um das Alter eines Bernsteins abzuschätzen:
- Normalerweise wird die Radiocarbonmethode angewendet.
- Es ist notwendig, das umgebende Sediment zu datieren.
- Je nach Sachlage werden verschiedene Methoden benutzt.
- Welche der folgenden Materialien weist die vom Bernstein am stärksten abweichende Dichte auf?
- Polyethylen
- Polyvinylchlorid
- Eichenholz
- Kolophonium
Giulia Realdon, Italien






