Was wissen wir über das Klima? Untersuchung der Einflüsse der vom Menschen verursachten Erderwärmung Understand article
Übersetzt von Anne Käfer. In diesem zweiten Teil untersucht der Klimaforscher Rasmus Benestad vom Norwegian Meteorological Institute (Norwegian Meteorologisk Institutt) die Beweise, dass die Menschen den Klimawandel verursachen.
Es ist wissenschaftlich anerkannt, dass es einen natürlichen Treibhauseffekt auf der Erde gibt, der den Planeten unbewohnbar macht. Was hat es also mit der vom Menschen bedingten Erderwärmung (AGW) auf sich? Es gab schließlich die natürlichen Klimaveränderungen schon lange bevor der Mensch eingriff, man braucht nur einen Blick auf die Eiszeiten zu werfen.
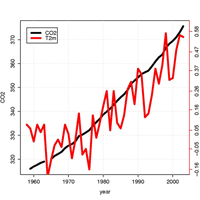
CO2-Konzentrationen (schwarz;
von Maria Lea, Hawaii) und die
durchschnittliche Erdtemperatur
(T(2m) orange, aber keine
Skalierung; Daten der NASA GISS)
Zum Vergrößern auf das Bild klicken
Mit freundlicher Genehmigung von
Rasmus Benestad
Aus theoretischen Betrachtungen würde man erwarten, dass die Temperatur ansteigen würde, wenn der Wärmeverlust gehemmt würde, während die Energiezufuhr konstant ist. Das Ansteigen der Treibhausgase (GHG´s) hat denselben Einfluss wie die Begrenzung des Wärmeverlusts, da GHG´s transparent für Sonnenlicht sind, aber lichtundurchlässig für Infrarotlicht, welches den Wärmeverlust der Erde zum Weltraum ausmacht. Dadurch zerstört ein ansteigender Treibhauseffekt das Strahlungs-Energiegleichgewicht.
Der erste empirische Hinweis für einen fortschreitenden Klimawandel beinhaltet einen ungefähr 30%-igen systematischen Anstieg des CO2– Niveaus seit dem vorindustriellen Niveau von 280 ppm (die schwarze Kurve in der Zeichnung zeigt das CO2-Niveau seit 1958).
Es besteht kein Zweifel, dass das CO2 von fossilen Quellen stammt, da die Isotopenverhältnisse zeigen, dass der Kohlenstoff deutlich weniger galaktischer, kosmischer Strahlung ausgesetzt war (GCRs). Wenn Protonen von GCRs mit Stickstoff-14 (sieben Protonen und sieben Neutronen im Kern) in der Luft zusammenstoßen, wird Kohlenstoff-14 durch folgende Kernreaktion (zusammen mit anderen Isotopen wie Beryllium-10) gebildet:
14N + p → 14C + n
Das bedeutet, dass Kohlenstoff mit niedrigem Anteil an Kohlenstoff 14 tief aus dem Boden kommen muss, außerhalb der Reichweite von kosmischer Strahlung.
Außerdem hat das Verhältnis von Sauerstoff zu Stickstoff abgenommen. Das wird wegen der zunehmenden Verbrennung fossiler Treibstoffe erwartet, wobei Sauerstoff mit Kohlenstoff zu CO2 reagiert. Die Ozeane werden also saurer, was zu einer Erhöhung des CO2-Anteils, sowohl in der Atmosphäre als auch in den Ozeanen führt.

iStockphoto / Rob Friedman
Schließlich kann Kohlenstoff nicht spontan von der Erdoberfläche verschwinden – unter normalen Umständen bleibt er erhalten. Daher wird erwartet, dass durch das Verbrennen fossiler Treibstoffe irgendwo in der Atmosphäre, in den Ozeanen und/oder der Biosphäre ein Plus an CO2 entsteht. Indem man fossilen Kohlenstoff tief aus dem Untergrund aufnimmt, entfernt man ihn aus diesen versteckten Reservoiren und setzt ihn auf der Erdoberfläche frei, wo er bleibt.
Gemäß dem Fourth Asssessment Report (AR4) des Intergovernmental Panel on Climate Change (IPCC) ist die Erddurchschnittstemperatur, errechnet aus Tausenden von einzelnen Thermometern rund um die Erde, um 0,74+- 0,18° C über die letzten 100 Jahre angestiegen, und es hat den Anschein, als würde sie weiter steigen. Einige auf Satellitenuntersuchungen basierende Studien haben schon über Änderungen in den spektralen Eigenschaften der Wärme, die von der Erde zurückgestrahlt wird, berichtet, parallel zu einem steigenden Treibhauseffekt. Bohrlochmessungen von der Erdoberfläche können ebenfalls benutzt werden, um Temperaturänderungen abzuleiten, und diese weisen ebenfalls darauf hin, dass es eine Erwärmung gegeben hat.
Der globale durchschnittliche Meeresspiegel steigt, sowohl durch die Tatsache, dass wärmeres Wasser ein größeres Volumen aufweist, als auch dass Gletscher geschmolzen sind. Es ist ebenfalls dokumentiert, dass viele Gletscher sich seit Ende des 19. Jahrhunderts zurückgezogen haben. Die Eisschicht in der Arktis hat wesentlich abgenommen, seit die Satellitenmessungen begannen, und die Schneehöhe nahm ebenfalls ab.
Es gibt einen weiteren Beweis aus dem Wasserkreislauf: Anzeichen von häufigeren und heftigeren Regengüssen und Änderungen der Stromstärken und Regenfallstatistiken.
Zusätzliche Beobachtungen aus der Biologie passen in das Bild eines globalen Klimawandels. Änderungen in der Baumgrenze, Jahresringbreite/Dichte, Korallen, Ablagerungen am Meeresboden und Stalagmiten legen Zeugnis darüber ab, wie sehr sich das Klima in der Vergangenheit verändert hat. Verglichen mit diesen Indikatoren scheint die gegenwärtige Erwärmung zumindest in den letzten 1000 Jahren außergewöhnlich zu sein.
Zweifel?
Diejenigen, die die Auffassung der vom Menschen verursachten Klimaerwärmung in Frage stellen, allgemein bezeichnet als Klimaskeptiker, haben argumentiert, dass die Erderwärmung eine Folge der Veränderungen in der Sonne ist. Aber moderne Messungen von kosmischen Strahlen, Sonnenflecken und anderen Indices, die den Zustand der Sonne beschreiben, deuten darauf hin, dass sie seit den 50iger Jahre nicht aktiver geworden ist (siehe Grafik).
Änderungen im Sonnenverhalten würden die Rolle von Treibhausgasen (GHG´s) beim Klimawandel nicht unbedingt ausschließen. Falls unser Klima empfindlich wäre gegenüber leichten Änderungen in der Sonne, dann würde das bedeuten, dass unser Klima leicht durch Änderungen im Energiegleichgewicht beeinflusst wird – noch ein stärkerer Grund zu glauben, dass Änderungen der GHG´s den globalen Klimawandel verursachen könnten.
Andere Faktoren könnten das Strahlungsgleichgewicht beeinflussen, wie Änderungen in der Umlaufbahn der Erde um die Sonne und die Solaraktivität. Es ist bekannt, dass Vulkane Partikel in die höhere Atmosphäre schleudern, die das Sonnenlicht blockieren, und sowohl natürliche als auch vom Menschen verursachte Aerosole können einen Trübungseffekt haben, der den Anteil der Sonnenenergie, der die Erdoberfläche erreicht, reduziert. Aerosole können auch den Hitzeverlust der Erde verursachen, das Nettoergebnis hängt von der Art der Partikel, ihrer Größe, ihrer Höhe und ihrer Konzentration ab.
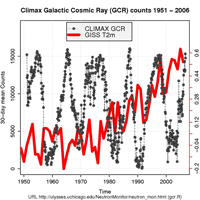
kosmischen Strahlen (GCRs;grau)
und der Erddurchschnittstem-
peratur (T(2m);blau). Obwohl es
keinen Langzeittrend im GCR
Verhalten gibt, ist die T(2m)
gestiegen. Zum Vergrößern
auf das Bild klicken
Mit freundlicher Genehmigung von
Rasmus Benestad
Veränderungen in der Bodenoberfläche können ebenfalls eine Rolle spielen, indem sie die Art, wie der Planet Licht reflektiert, und auch den Austausch von Feuchtigkeit und Energie zwischen der Oberfläche und der Atmosphäre verändern.
Manche Skeptiker behaupten, dass die Erderwärmung eine Täuschung sei, bedingt durch den Effekt der Verstädterung. Jedoch erklärt dies nicht, dass sich viele Weltozeane sowohl an der Oberfläche als auch in der Tiefe erwärmt haben – wo keine Städte sind. Es erklärt auch nicht, warum die größten Erwärmungen in der Arktis, in Alaska und in Sibirien beobachtet wurden. Außerdem wurde der Einfluss der Städte auf die Temperatur untersucht und bei der Schätzung des globalen Durchschnitts berücksichtigt.
Ein anderes Argument, das von Klimaskeptikern genutzt wird, ist, dass die Satellitenmessungen der Temperatur in der Atmosphäre nicht dieselbe Erwärmung wie auf dem Boden zeigen. Diese Diskrepanz war durch Fehler bei der Analyse der Satellitendaten bedingt; die Trends in der freien Atmosphäre konnten jetzt mit den Oberflächendaten in Einklang gebracht werden.
Es wird auch behauptet, dass unsere Atmosphäre schon lichtundurchlässig für Infrarotstrahlung ist und deshalb gesättigt ist; weitere Zugabe von CO2 könne keinen größeren Einfluss haben. Jedoch muss man nur zur Venus schauen, um zu sehen, dass die Atmosphäre nicht so einfach gesättigt wird. Man kann dies auch theoretisch beweisen. Außerdem ist es nicht nur der Einfluss von CO2, der von Bedeutung ist, es gibt auch andere wichtige Prozesse, die auf den sich ändernden Treibhauseffekt vergrößernd (wie z.B. das sich zurückziehende Eis der Meere oder Luftfeuchtigkeit) oder dämpfend (z.B. tiefe Wolken) wirken.
Aber hatte sich das Klima nicht schon immer geändert? Es gibt Gelehrte, die behaupten, dass unser Klima ein natürliches zyklisches Verhalten zeigt. Woher wissen wir, dass die derzeitige Erwärmung nicht nur ein Teil eines natürlichen Kreislaufs ist, wie eine Erholung aus einer kurzen Eiszeit?
Wir können von den physikalischen Gesetzen ableiten, dass sich die Durchschnittstemperatur nicht spontan ändert, da Hitze konserviert werden muss. In der Vergangenheit hat irgendetwas Besonderes die Änderungen verursacht – seien es Änderungen in der Erdumlaufbahn oder in der Zusammensetzung der Atmosphäre, Solaraktivität, Vulkane oder Landschaftsänderungen. Keiner dieser Faktoren, ausgenommen die Änderungen der GHG-Konzentrationen, kann die aktuelle Erwärmung erklären. Ebenso können Änderungen im System selber, wie z.B. El Niňo Southern Oscillations, einige Schwankungen hervorrufen, aber diese sind wohl schwächer, verglichen mit Änderungen durch externe Kräfte. Und trotzdem gibt es immer noch eine physikalische Erklärung für die Änderungen, egal ob extern oder intern.
Können wir den globalen Klimamodellen (GCMs) tatsächlich glauben? GCMs sind nicht perfekt, aber sie sind noch das beste Werkzeug, um Vorhersagen für die Zukunft zu machen. Ein GCM kann als ein Puzzlespiel betrachtet werden, wobei das große Bild aus vielen kleinen Teilen hervorgeht, die in einer wohl organisierten Art und Weise zusammengesetzt werden. GCMs beinhalten alles, was wir über das Klimasystem in Form von physikalischen Gesetzen und empirischen Daten wissen, und sie liefern ein umfassendes Bild durch numerische Methoden auf großen Computern. Einige Gleichungen, die diese Prozesse beschreiben, können nicht exakt gelöst werden, aber Schätzungen liefern dennoch eine gute Darstellung.
Prognosen für die Zukunft
Was können wir von einer AGW erwarten? Die wissenschaftlichen Erkenntnisse, die in wissenschaftlichen Zeitschriften veröffentlicht werden, wurden im IPCC Bericht gesammelt, welcher daraus das Bild für die Zukunft entwirft.
Gemäß dem AR4, führt eine AGW sehr wahrscheinlich zu einer generellen Erwärmung, mit einer stärkeren Auswirkung auf die Arktis und die Kontinente. In den Subtropen kann es mehr Trockenheit geben, aber in höheren Breitengraden werden mehr Niederschläge erwartet. Der Bericht weist darauf hin, dass es mehr Überschwemmungen und Hungersnöte geben wird. Die Gletscher könnten schmelzen und die Versorgung an Trinkwasser für einen Großteil der Weltbevölkerung gefährden Eine Erhöhung des Meeresspiegels wird die tiefer gelegenen Küstenregionen treffen, und in einigen Regionen könnten die Menschen gezwungen sein, in höher gelegene Gebiete umzusiedeln.
Die 2005-er Hurrikansaison produzierte eine zumindest in der Neuzeit beispiellose Anzahl von tropischen Wirbelstürmen in der Karibik/Nordatlantik, einige von ihnen führten zu schweren Katastrophen und heftigen Schäden. Wird es heftigere Hurrikans/Taifune geben, wenn die Welt wärmer wird? Und werden wir jetzt Zeugen eines Trends in der Aktivität tropischer Wirbelstürme? Im Moment können wir nicht sicher sein, aber es gibt schon einige Hinweise dafür, dass die Gefahr für starke Stürme steigen könnte und dass es eine Aufwärtsentwicklung in der Aktivität verbunden mit intensiveren tropischen Wirbelstürmen über einigen Ozeanen gegeben hat.
Kondensstreifen

Dieses MERIS (MEdium Resolution Imaging Spectrometer) zeigt einen Großteil Nordosteuropas, einschließlich Bereiche von Deutschland, Schweden, Polen und Dänemark.
Die gestreckten Wolken rund um und im Osten Dänemarks, die besonders über dem Meer zu sehen sind, sind Kondensstreifen, die durch Wasserdampf der Flugzeuge gebildet werden. Die Anzahl der Kondensstreifen zeigt den starken Luftverkehr am Himmel. Man kann annehmen, dass diese Streifen Zirruswolken in großer Höhe bilden, die zur globalen Erwärmung beitragen könnten.
Arbeiten mit dem ESA Data User Element (DUE) beinhalten laufend Studien über Kondensstreifen und Einflüsse, die sie auf den Klimawandel haben könnten.
Soziale Aspekte
Zusätzlich zu den wissenschaftlichen Erkenntnissen bezüglich der AGW, gibt es offensichtlich auch ethische Aspekte, verbunden mit der Erkenntnis, dass reiche Länder die Hauptverantwortung für die steigenden Emissionen von GHGs tragen, aber am wenigsten davon betroffen sind.w1 Es gibt auch Energieüberlegungen und die Frage, ob erneuerbare Energiequellen die fossilen Quellen ersetzen können. Darüber hinaus sind wirtschaftliche Betrachtungen und politische Entscheidungen, die den Klimawandel betreffen, eng mit Energieoptionen und Emissionen von Treibhausgasen verbunden.
Tatsächlich könnte die Klimadebatte zu den wichtigsten Problemen unserer Zeit gehören. Es wäre eine Schande, wenn ein breiteres Publikum nicht an der Debatte teilnehmen könnte, da es sie nicht versteht. Folglich ist es wichtig, dass Schulen das Thema Klima und Klimawandel in ihre Lehrpläne übernehmen und dass die Informationen genau und aktuell sind.
Web References
- w1 – Zur Diskussion der Politik des Klimawandels siehe www.OpenDemocracy.net
Review
Jeder hat schon mal was über Klimawandel gehört. Das Thema ist häufig in den Medien, aber die gegebene Information ist oftmals unvollständig oder manipuliert durch politische Meinungen. Als Naturwissenschaftslehrer müssen wir den Schülern korrekte Informationen und Instrumente anbieten, damit sie kritische Meinungen entwickeln können, die auf Fakten basieren und sie zu mündigen Bürgern machen.
Dieser zweite der beiden Artikel von Rasmus Benestad ist sehr nützlich, da er das Thema klar und objektiv darstellt und den Beweis für den vom Menschen bedingten Klimawandel liefert.
Ich empfehle Naturwissenschaftslehrern diesen Artikel, die dazu bereit sind, ihr Wissen auf dem neuesten Stand zu halten, sowie Schülern, die an den Fakten und den wissenschaftlichen Hinweisen im Kern der Debatte interessiert sind. Das Material ist besonders geeignet für Klassendiskussionen und für einen fächerübergreifenden Ansatz zu einer umweltfreundlichen Erziehung an weiterführenden Schulen.
Giulia Realdon, Italien





