Fialové výpary: význam jodu Understand article
Přeložila Zdena Tejkalová. Jod se svými charakteristickými fialovými výpary má nesčetné množství aplikací – od dezinfekce až k inovativním solárním článkům.

Obrázek se svolením Eleanor A
Merritt
Proč je jod tak důležitý a zajímavý? Nejenže sublimuje a přechází na fialový plyn, ale rovněž ovlivňuje mnoho aspektů života na Zemi a lidské civilizace. Věděli jste, že jod chrání mořské řasy před oxidačním poškozením (např. od Slunce), zabraňuje tvorbě vrozených abnormalit v lidském těle a má řadu průmyslových aplikací?
Objev jodu se datuje do období napoleonských válek v 19. století. Kvůli britské blokádě evropských přístavů se Francouzi potýkali s nedostatkem ledku (KNO3), potřebného k výrobě střelného prachu. Chemik Bernard Courtois objevil mořské řasy (chaluhy, Laminaria sp.) jako zdroj draslíku. K popelu mořských řas přidal koncentrovanou kyselinu sírovou a k jeho překvapení se objevily fialové páry.

Gay-Lussaca, francouzského
fyzika a chemika, namaloval
François Séraphin Delpech
(1778–1825)
Public domain image /
Wikimedia Commons
Ačkoli Courtois předpokládal, že fialové výpary jsou novým prvkem, neměl finanční prostředky pro pokračování svého výzkumu. Jeho kolegové, mezi kterými byl i Joseph Gay-Lussac, potvrdili jeho výsledky, a nový prvek pojmenovali jod. Toto slovo vychází z řeckého iodes, což znamená purpurový či fialový.
Gay-Lussac pokračoval ve zkoumání chemie jodu. Navzdory válce francouzští chemici našli možnost korespondence s britskými chemiky, zejména se sirem Humphryem Davyem. Z počátku Davy předpokládal, že páry jsou sloučeninou chloru, ale brzy došel k závěru, že jde skutečně o nový prvek.

patřící do čeledi
Laminariacea) jsou
nejsilnějšími akumulátory
jodu mezi živými systémy.
Fotografie byla pořízena na
břehu v Dunstaffnage, poblíž
Oban, Skotsko, UK
Obrázek se svolením FCK
S pomocí rentgenové absorpční spektroskopie lze pozorovat, že mořské řasy akumulují jod ve formě jodidu (I–), který působí jako antioxidant proti poškození vyvolanému atmosférickým ozonem (O3). Toto nabízí částečné vysvětlení toho, proč lze v atmosféře pobřežních oblastí detekovat stopové množství molekulárního jodu (I2), a proč je příjem jodu člověka v těchto oblastech závislý na množství mořských řas, spíše než blízkosti moře.
Skoro celé následující století byl jod extrahován z mořských řas. V současné době se získává z přírodních solných roztoků, obsahujících jod v plynových a ropných polí v Japonsku a USA, nebo z chilských kalkrust (caliche, dusičnanové rudy), které obsahují jodičnan vápenatý (Ca(IO3)2). Jod je dodáván na trh ve formě purpurově-černé pevné látky.
Chemie jodu
Jod patří mezi halogeny, má tedy mnoho společných vlastností s dalšími prvky této skupiny. Kvůli své vysoké elektronegativitě tvoří jod s většinou prvků jodidy, ve kterých má oxidační číslo -I. Mnoho jodidů je často využíváno v organické syntéze – většinou k jodaci, oxidaci a tvorbě vazby C-C.
Jod v atmosféře pochází převážně z biologických a chemických procesů v oceánech – například jodidový antioxidační systém mořských řas. Většina jodu je nakonec z atmosféry odstraněna při tvorbě mraků. V oceánech je jod rozpuštěný ve formě jodičnanů (IO3–, oxidovaná forma) a jodidů (I–, redukovaná forma). Ve vnějším zemském obalu (litosféře) je většina jodu obsažena v mořských a pozemských sedimentech; množství jodu ve vyvřelinách je velmi nízké.
Fyziologický význam jodu
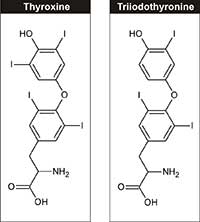
(T4) a trijodtyrosin (T3)
Obrázek se svolením Michaela
Zimmermanna
Fyziologicky se jod řadí mezi esenciální prvky, je nezbytný pro syntézu tyroidních hormonů – trijodtyrosinu a tyroxinu (obrázek 3) – tyto hormony regulují růst, vývoj a buněčný metabolismus. Doporučený denní příjem jodu pro dospělé je 150 µg, které je možno získat z mléčných produktů, mořských řas a jodizované soli.
Klasickým příznakem nedostatku jodu je zvětšení štítné žlázy (vole). Jak klesá příjem jodu, žláza přední hypofýzy produkuje více hormonu pro stimulaci štítné žlázy, aby umožnila maximální využití dostupného jodu. Toto vede k nadměrnému růstu štítné žlázy.
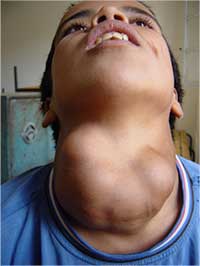
způsobené nedostatkem jodu
Obrázek se svolením Michaela
Zimmermanna
Největší škody jsou při nedostatku jodu způsobeny během vývoje dětského mozku a mohou vést až k mentální retardaci. Mimoto velký nedostatek jodu v těhotenství je spojován s větší pravděpodobností porodu mrtvého dítěte, potratem a vrozených vad.
Nejefektivnějším způsobem, jak předcházet nedostatku jodu, je přidání jodidu draselného (KI) nebo jodičnanu draselného (KIO3) do kuchyňské soli. Tato jodizace soli se využívá v přibližně 120 zemích, celkově více než 70 % světové populace má přístup k jodizované soli.
Průmyslové využití jodu
Jod a jeho sloučeniny jsou využívány v obrovské škále produktů od potravin přes léčiva, až ke zvířecímu krmivu a průmyslovým katalyzátorům (obrázek 4). Mj. je jod účinným antimikrobiálním prostředkem. Více než sto let byla jodová tinktura – směs ethanolu, vody, jodu a jodidu draselného – využívána jak antiseptikum při ošetření ran. V současné době je nahrazována ionofory (komplexy jodidů a surfaktantů), které tolik nedráždí pokožku. Například tzv. jodovaný povidon, což je směs polyvinylpyrrolidonu a jodu, je využíván jako chirurgická desinfekce.
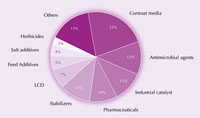
jodu
Obrázek se svolením Tatsuo
Kaiho
V průmyslové výrobě kyseliny octové se jako katalyzátory využívají sloučeniny jodu, jako např. jodid rhoditý (Monsantův proces) či jodid rhoditý (BP Cativa proces) jsou využívány ke katalýze karbonylace methanolu.
Jodid stříbrný (AgI), dříve využívaný ve fotografických deskách, se nyní využívá při vyvolávání umělého deště a úpravě klimatu. Protože krystalová struktura AgI se podobá ledu, dokáže vyvolat mráz, pokud jsou k dispozici místa k nukleaci (nucleation sites). Toto bylo využito jako prevence deště při zahajovacím a závěrečném ceremoniálu olympiády v Pekingu v roce 2008.

po stranách dva generátory z
jodidu stříbrného pro tvorbu
umělého deště (tzv. cloud
seeding)
Obrázek se svolením Christian
Jansky / Wikimedia
Se svou vysokou atomovou hmotností (126,9) a velkým počtem elektronů je jod vynikajícím absorbentem RTG paprsků a je užíván při přípravě radiokontrastních látek. Tyto sloučeniny jsou bezpečné pro humánní využití a umožňují vizualizaci měkkých tkání v rentgenovém záření.
Všední využití jodu je v tekutých krystalech do obrazovek televizorů, počítačů a mobilních telefonů, které využívají polarizační folie k filtraci světla. Tyto folie jsou běžně vyráběny z jodovaných vrstev polyvinylalkoholu (PVA). Zde jod zajišťuje síťování a také polarizaci celé struktury.
Jod v energetickém průmyslu

francouzském Tricastin se
nachází blízko hustě
zalidněné oblasti. Přibližně
každých pět let jsou tablety
jodidu draselného
distribuovány lidem žijícím v
jejím okolí. Toto opatření má
preventivní účinek proti
poškození štítné žlázy v
případě jaderné nehody
Obrázek se svolením AIEA
/Wikimedia
Jod je využíván v nejslibnějších solárních článcích pro produkci nízkonákladové “zelené energie”: barvivem senzitizované solární články z oxidu titaničitého. Je také známý jako Grätzelův článek, byl pojmenován po jednom ze svých vynálezců. Obsahuje polyjodidový elektrolyt jako transportní vrstvu náboje mezi katodou a anodou (pokud se chcete dozvědět více, podívejte se na Shallcross et al., 2009).
Ze 37 známých izotopů jodu jsou radioaktivní všechny, s výjimkou 127I. Většina těchto radioizotopů, produkovaných štěpnými reakcemi v jaderných elektrárnách a zbraních, má krátký poločas rozpadu, což z nich dělá užitečné zobrazovací a terapeutická medicínská činidla. Například izotopy jodu mohou být využity k zobrazení štítné žlázy, která absorbuje radioaktivní jod injekčně aplikovaný do krevního řečiště.
Bohužel radioaktivní 131I uvolňovaný při jaderných nehodách – jako např. v japonské Fukušimě v roce 2011 – je také absorbován štítnou žlázou. Protože je to zářič vysokoenergetických β částic, poškozuje buňky a vyvolává rakovinné bujení. K potlačení tohoto efektu se využívají tablety neradioaktivního jodidu draselného (KI) – ten v podstatě nasytí kapacitu štítné žlázy, která potom neabsorbuje radioaktivní jod.
Toto byl pouze malý vzorek možného využití jodu. Ačkoli je tento prvek známý přes dvě stě let, je i nyní hojně využíván v moderní chemii, fyzice a medicíně.
Jod ve třídě
Bezpochyby všichni známe barevné “jodové hodiny”, reakci peroxide vodíku, jodidu draselného, škrobu a thiosíranu sodného – ale existuje mnoho dalších způsobů, jak prakticky představit jod ve třídě. Například:
- Za katalýzy vodou hliník a jod reagují za vzniku pozoruhodného oblaku fialových jodových par.
- Jodid draselný lze využít ke zjištění přítomnosti škrobu v celé škále potravin.
- Jodid draselný lze využít ke zjištění přítomnosti škrobu v celé škále potravin.
- Různé roztoky, včetně vodného jodidu sodného, mohou být elektrolyzovány a produkty této elektrolýzy na elektrodách identifikovány. Studenti využijí své praktické zkušenosti i teoretické znalosti při zápisu jednoduché iontové rovnice.
Podrobnosti k těmto a mnoha dalším školním pokusům lze najít na webových stránkách Learn Chemistryw1.
Poděkování
Tento článek byl adaptován z publikace v Angewandte Chemie International Edition (Küpper et al., 2011).
References
- Küpper FC, Feiters MC, Olofsson B, Kaiho T, Yanagida S, Zimmermann MB, Carpenter LJ, Luther GW, Lu Z, Jonsson M, Kloo L (2011) Commemorating two centuries of iodine research: an interdisciplinary overview of current research. Angewandte Chemie International Edition 50: 11598-11620. doi: 10.1002/anie.201100028
- Shallcross D, Harrison T, Henshaw S, Sellou L (2009) Looking to the heavens: climate change experiments. Science in School 12: 34-39.
Web References
- w1 – Webová stránka Britské královské chemické společnosti nabízí ke stažení širokou škálu materiálů pro výuku a studium chemie.
Review
V tomto aktuálním článku o jodu provedou autoři čtenáře historií a aplikacemi tohoto důležitého prvku, od medicíny přes průmysl až po produkci energie. Návrhy školních experimentů zvyšují zajímavost a atraktivitu tématu.
Vzhledem k jasnému stylu nedoporučuji tento článek pouze evropským učitelům přírodních věd, ale také jejich studentům ve věku 13-18 let. Může být využit v hodinách chemie (periodická tabulka, halogeny), biologie (endokrinní žlázy, štítná žláza a její onemocnění) a fyziky (isotopy, radioaktivita a solární články). Nabízí se rovněž interdisciplinární využití při výkladu historie vědy (objev prvků), role vědců při rozvoji zbraní, či vztahu mezi vědci ze znepřátelených zemí během válek.
Navrhované otázky k porozumění tématu:
- Z článku je možné vydedukovat, že řasy akumulují jod kvůli:
- Oxidaci atmosférického ozonu
- Absorbci atmosférického ozonu
- Produkci atmosférického ozonu
- K ochraně sebe samých před vzdušným ozonem
- Pokud nepřijímáme dostatek jodu:
- Naše štítná žláza se zvětší / atrofuje
- Naše žláza přední hypofýzy produkuje méně/více hormonu pro stimulaci štítné žlázy
Giulia Realdon, Itálie





