Süße Einblicke in Infektionen durch parasitäre Würmer Understand article
Übersetzt von Inci Aydin. Schistosomiasis ist sozioökonomisch die zweitverheerendste parasitische Krankheit nach Malaria. Alan Wilson und Stuart Haslam erforschen neue Wege, den Parasiten zu bekämpfen, indem sie sich seine zuckerhaltige Hülle zu Nutze machen.
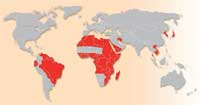
von Schistosomiasis. Zum
Vergrößern auf das Bild
klicken
Mit freundlicher Genehmigung
von Percherie; Bildquelle:
Wikimedia Commons
Schistosomiasis ist eine bedeutende parasitische Krankheit (auch bekannt als Bilharziose), die Menschen und domestizierte Nutztiere infiziert, und durch mehrere verschiedene Plattwurmarten der Gattung Schistosoma verursacht wird. Die Weltgesundheitsorganisation schätzt, dass mindestens 200 Millionen Menschen in Teilen Südamerikas, Afrikas und Asiens infiziert sind. Ungefähr 280 000 Menschen sterben jedes Jahr im subsaharischen Afrika an Schistosomiasis, und Millionen mehr sind chronisch erkrankt. Typische Symptome umfassen abdominale Schmerzen, Durchfall, Fieber, Anämie und Abgeschlagenheit; dass, das Wachstum und die geistige Entwicklung von Kindern gehemmt werden, ist eine weitere Konsequenz der Infektion. Schistosomiasis bleibt daher ein wichtiges Problem des Gesundheitswesens in Entwicklungsländern.
Die Plattwürmer durchlaufen eine Reihe von Stadien: (siehe Lebenszyklus) Eier, freischwimmende Larven (Miracidien), Sporocysten, ein zweites Stadium freischwimmender Larven (die Cercarien) und schließlich die ausgewachsenen Würmer. Ein vollständiger Lebenszyklus dauert mindestens 12 Wochen.
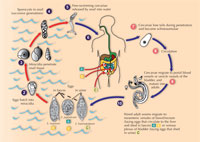
Plattwurmparasiten
Schistosoma. Zum
Vergrößern auf das Bild
klicken
Mit freundlicher Genehmigung
von Public Health Image
Library.
Wurmeier werden in das Wasser freigelassen, wenn menschliche Fäkalien oder Urin in Flüsse oder andere Gewässer gelangen. Süßwasserschnecken verschiedener Gattungen stellen Zwischenwirte der Plattwürmer dar, und die Anwesenheit von geeigneten Schneckenarten bestimmt die Verbreitung der Krankheit. Kontakt der Eier mit Wasser führt dazu, dass innerhalb von Minuten Miracidien ausschlüpfen, die in den Fuß der Schnecke eindringen, wonach die Larven Sporocysten gennant werden. Die Sporocysten durchleben asexuelle Reproduktion innerhalb der Schnecke, wobei tausende aquatische Cercarien entstehen, die Menschen durch Penetration der Haut infizieren. Cercarien können eine einzelne Schnecke über einen Zeitraum von einer Woche verlassen, was einen bedeutenden Vermehrungsschritt im Lebenszyklus des Parasiten repräsentiert: ein Miracidium führt zu zehntausenden Cercarien bevor die Infektion abklingt. Der häufigste Weg, Schistosomiasis zu bekommen, ist beim Durchwaten von oder Schwimmen in Seen oder anderen Gewässern, die von infizierten Schnecken befallen sind. Nichtmenschliche Wirte umfassen andere Säugetiere, wie auch Vögel und Krokodile.
Innerhalb des menschlichen Wirts gelangen die Larven durch den Blutkreislauf in die Nierenpfortader zwischen Darm und Leber (im Fall von Schistosoma mansoni oder S. japonicum) oder Venen der Harnblase (im Fall von S. haematobium). Dort ernähren sie sich von roten Blutezellen, entwickeln sich zum Adultstadium und paaren sich. Das zentimeterlange Männchen reißt das längere und dünnere Weibchen an seine ventrale Furche, wo sie verbleiben wird, und transportiert sie mithilfe einer Kombination von oralen und ventralen Saugern gegen den Blutfluss zu kleineren Blutgefäßen des Wirts. Hier drängt sie sich nach vorn, vorne an der Furche des Männchens herausragend, um hunderte von Eiern in die Blutgefäße abzulegen. Wenn erstmal gebildet, können die adulten Würmer Jahrzehnte lang in der feindlichen Umgebung der Blutbahn des Wirts leben, möglicherweise anfällig für einen Angriff durch das Immunsystem. Schließlich müssen die Eier in den Darm oder die Blase entfliehen, um in Fäkalien oder Urin nach außen zu gelangen, sodass der Lebenszyklus fortgesetzt werden kann.
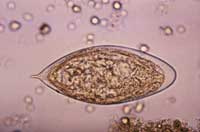
haematobium Ei, 500-fach
vergrößert
Mit freundlicher Genehmigung
von Public Health Image Library
Die adulten und larvalen Würmer sind vergleichsweise harmlos zu ihrem menschlichen Wirt, aber die Eier können eine schwerwiegende Erkrankung verursachen. Der Schweregrad des Gewebeschadens, der durch die Eier verursacht wird, hängt sowohl mit der Anzahl der Würmer, die eine Person akkumuliert, als auch mit der Intensität der humanen Immunantwort auf die Eier zusammen: eine zu starke entzündliche Reaktion führt letztendlich zu mehr Gewebeschaden, eine zu schwache zu Gewebenekrose durch die Eiproduktion. Außerdem verlässt ein großer Anteil der Eier nicht den Wirt. Stattdessen werden sie in S. mansoni and S. japonicum Infektionen über den Blutkreislauf in die Leber befördert, wo sie sich einnisten. Folglich bilden sich um die Eier fibröse Schichten von Immunzellen (Granulome genannt) – es ist eher diese Reaktion als die Würmer selbst, die das lebensbedrohliche Syndrom verursacht. S. haematobium Eier sind genauso gefährlich und verursachen Fibrose – die Bildung von übermäßigem fibrösem Bindegewebe – in der Blasenwand.
Wir waren daran interessiert, wie der Parasit in den menschlichen Körper eindringt und ihn wieder verlässt. Sowohl in dem cercarialen Stadium, das die Haut des Wirts penetriert, als auch das Ei, das durch die Darm- oder Blasenwand ausbricht, setzt der Parasit Sekrete frei, die ihm helfen, sich durch den Körper des Wirts zu bewegen. Die Cercarien besitzen eine Reihe spezialisierter Drüsenzellen. Diese setzen eine Mischung von Proteinen frei, von denen gezeigt wurde, dass sie den Larven dabei helfen, das starke Stratum Corneum – die äußerste Schicht der Haut – und dann die Dermis zu durchqueren, und schließlich ein Blutgefäß zu durchdringen. Die Absonderungen der Eier werden durch ein spezialisiertes Gewebe, die Hülle, das unterhalb der Eischale liegt und vollständig die darin wachsende Miracidiumlarve umgibt. Die Sekrete sind zu groß, um die Kapillarbetten zu durchqueren, sodass sie sich, wenn in die Blutgefäße freigesetzt, stromabwärts zum nächsten Organ bewegen – die Leber, im Falle von S. mansoni.
Langfristig könnten die cercarialen Absonderungen ein geeignetes Ziel für ein Medikament zur Behandlung von Schistosomiasis sein oder für einen Impfstoff zur Vorbeugung. Aber um ein wirksamenes Medikament zu entwickeln, müssen Wissenschaftler wissen, wie die Absonderungen funktionieren und woraus sie bestehen. Wir haben die Proteine in den Absonderungen sowohl der Cercarien als auch der Eier mithilfe von Massenspektrometrie (siehe Kasten) charakterisiert und haben gezeigt, dass sie eine relativ einfache Zusammensetzung haben. Cercariale Sekretionen beinhalten einige Enzyme, die Proteine abbauen (Proteasen genannt), sowie eine Reihe von Proteinen und Glycoproteinen, die die Immunantwort des Wirts verändern könnten. Die von den Eiern abgesonderten Proteine haben auch proteinabbauende Aktivität, obwohl wir nicht genau wissen, wie sie funktionieren, da die Aminosäuresequenzen der Hauptkomponenten anders sind als die anderer Proteinen mit bekannter Funktion.
mansoni
Mit freundlicher Genehmigung
von Public Health Image Library
Es ist sehr ungewöhnlich für einen Parasiten, dass die Absonderungen sowohl des Eis als auch der Cercarien sehr immunogen sind – sie verursachen starke Antikörperantworten durch das Immunsystem des Wirts. Aber was macht die Sekretionen so immunogen? Studien über die Reaktionen von Menschen, Primaten und Nagetieren auf die Infektion (Kariuki et al., 2008) haben gezeigt, dass die überwiegende Mehrheit der Antikörper gegen die Sekretionen sowohl der Larven als auch der Eier eher die Kohlenhydrate (Glykan) als den Proteinteil der sekretierten Glykoproteine erkennt. Also was sind Glykoproteine? Und was ist die Rolle der Glykane in der Biologie der Parasiten?
Das zentrale Dogma der modernen Biologie sagt aus, dass DNA die Grundvorlage des Lebens codiert, und dass die Information im DNA Code erst in mRNA übersetzt wird und schließlich in Proteine, die viele der fundamentalen Aufgaben sowohl in als auch zwischen den Milliarden von Zellen ausführen, die einen so komplexen lebenden Organismus wie den Menschen aufbauen. Aber zu sagen, dass es nur drei Haupttypen von Molekülen in lebenden Systemen gibt, ist eine allzu starke Vereinfachung. Schätzungsweise mehr als die Hälfte aller Proteine in Menschen sind durch die Addition von Zuckermolekülen modifiziert, was Glykoproteine bildet. Da Moleküle und Zellen sich gegenseitig erkennen, spielen diese Glykoproteine eine bedeutende Rolle in den vielen Interaktionen, die bestimmen wie Krankheiten sich verbreiten oder bekämpft werden.
Jede Zelle im menschlichen Körper (tatsächlich, in allen Eukaryoten) ist mit einer zuckerreichen Schicht umhüllt, die Glycocalyx genannt wird. Glykane an der Außenseite der Glycokalyx dienen als Identitätskennzeichen und interagieren mit einer Vielzahl von Rezeptoren (Erkennungsmoleküle) auf der Membran von umgebenden Zellen und helfen somit, das soziale (korrekte) und anti-soziale (fehlgeleitete) Verhalten unserer Zellen zu kontrollieren. Der Wurmparasit scheint, diesen Glykanerkennungsprozess auszunutzen, um das Immunsystem des Wirts zu manipulieren und dem Wurm seinen Lebenszyklus zu vollenden. Durch die Charakterisierung der detaillierten Struktur der wichtigen Wurmglykane möchten wir mehr darüber verstehen, wie diese Interaktionen stattfinden.
Die von uns gewählte Methode, um die Glykanstrukturen abzuleiten, ist Massenspektrometrie (siehe Kasten), da sie überaus sensitiv ist (man kann Daten von sehr winzig kleinen Materialmengen, wie zum Beispiel 1 Femtomol = 1 Milliardstel einer Millionstel (10-15) eines Mols erhalten), und sie kann für die Untersuchung von sehr komplexen Mischungen benutzt werden. In einem Experiment mit dem Massenspektrometer wird Energie auf die aufgereinigten Wurmglykane übertragen, z.B. indem sie mit einem Laserstrahl bestrahlt werden. Sobald sie eine Ladung haben, können sie veranlasst werden, durch den analytischen Abschnitt des Massenspektrometers zu „fliegen“. Dort werden verschiedenen Glykane gemäß ihrem Masse-zu-Ladungsverhältnis getrennt. Aus dieser Information kann die Struktur der Glykane hinsichtlich ihrer Monosaccharidzusammensetzung und ihrer Verbindung abgeleitet werden. Unsere Massenspektrometrieanalysen haben aufgedeckt, dass Sekretionen sowohl der Cercarien als auch der Eier sehr ähnliche, hoch immunogene Glykanstrukturen enthalten.
Im Fall des nicht-motilen Eis ist es so als ob das Ei versucht, Aufmerksamkeit auf sich zu ziehen. Das hat uns zu dem Gedanken gebracht, dass das Parasitenei sogar an die Wirtsimmunantwort, die Faktoren wie Proteasen herstellt, angewiesen ist, um aus den Blutgefäßen in das Darmlumen oder die Blase zu entkommen. Warum die Eier riskieren, vom Immunsystem angegriffen zu werden – wenn sie ihre eigenen Proteasen haben – bleibt ungeklärt.
Im Fall der mobile Cercarien schlagen wir eine Nebelwand Hypothese: Wir denken, dass die Cercarien „absichtlich“ Aufmerksamkeit auf ihre sekretierten Glycoproteine ziehen, um die Wirtsummunantwort gegen Proteine der Larve, die wichtiger für ihr Leben sind, abzulenken. Ausgerüstet mit einem detaillierten Wissen über die Glykanstrukturen des Parasiten, hoffen wir, in Zukunft neue Medikamente gegen den Parasiten oder Impfstoffe zu entwickeln.
Massenspektrometrie
Massenspektrometrie ist eine analytische Methode zur Bestimmung der elementaren Zusammensetzung einer Probe oder eines Moleküls. Sie kann sowohl für qualitative als auch quantitative Messungen verwendet werden. Sie ist nicht nur wichtig für Proteinanalysen, sondern wird auch häufig bei Weltraummissionen benutzt, um die Zusammensetzung von Gestirnen zu charakterisieren. Das Prinzip besteht darin, die Moleküle oder Molekülfragmente in der Probe zu ionisieren und dann ihr Masse-zu-Ladung-Verhältnis zu messen.
Ein Massenspektrometer, das für diese Methode verwendete Gerät, setzt sich allgemein aus drei Teilen zusammen (siehe Abbildung unten):
- Die Ionenquelle, in der die Probe in Gasphaseionen gespalten wird.
- Das Massenanalysegerät, in dem elektromagnetische Felder angelegt werden, um die Ionen nach ihrem Masse-zu-Ladung-Verhältnis zu trennen. Diese Felder üben Kräfte auf die Ionen aus; das elektrische Feld kann ein geladenes Partikel beschleunigen oder abbremsen, und seine Richtung kann durch das magnetische Feld verändert werden. Das Ausmaß der Auslenkung der Bahnlinie des sich bewegenden Ions hängt von seinem Masse-zu-Ladung-Verhältnis ab: laut dem zweitem newtonschen Gesetz werden leichtere Ionen stärker von magnetischer Kraft ausgelenkt als schwerere Ionen.
- Der Detektor, der das Masse-zu-Ladung-Verhältnis der Ionen aufnimmt und quantifiziert.
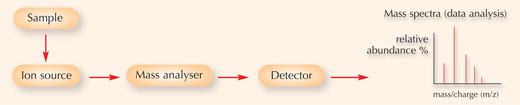
Diese Information wird dann benutzt, um die chemische Elementarzusammensetzung der ursprünglichen Probe zu bestimmen.
Danksagungen
Diese Arbeit wurde finanziert durch das Biotechnology and Biological Sciences Research Council (BBSRC) und dem Wellcome Trust, mit zusätzlicher Unterstützung durch das UNDP/World Bank/World Health Organization Special Programme for Research and Training in Tropical Diseases.
References
- Kariuki TM, Farah IO, Wilson RA, Coulson PS (2008) Antibodies elicited by the secretions from schistosome cercariae and eggs are predominantly against glycan epitopes. Parasite Immunology 30(10): 554-62. doi: 10.1074/mcp.M700004-MCP200
Resources
- Jang-Lee J, Curwen RS, Ashton PD, Tissot B, Mathieson W, Panico M, Dell A, Wilson RA, Haslam SM (2007) Glycomics analysis of Schistosoma mansoni egg and cercarial secretions. Molecular and Cellular Proteomics 6: 1485-1499. doi:10.1074/mcp.M700004-MCP200
- Für weitere Informationen über Schistosomiasis, siehe: www.york.ac.uk/res/schisto/background.htm
- Für mehr Informationen über Massenspektrometrie, siehe: www3.imperial.ac.uk/lifesciences/research/molecularbiosciences/massspec
