Cristalele biologice: la interfaţa dintre fizică, chimie şi biologie Understand article
Tradus de: Izabela Duminică, Colegiul Naţional “Nicolae Bălcescu”. Dominique Cornuéjols de la European Synchrotron Radiation Facility ne introduce într-o lume a cristalografiei. Nu e totul doar diamante sclipitoare…

/iStockphoto
“Cristal” nu este un cuvânt care ne vine imediat în minte când ne gândim la biologie. Cristalele sunt mai bine cunoscute ca reprezentate magnifice ale lumiii minerale. Pietrele preţioase, stelele strălucitoare ale lumii subterane, ne-au fascinat încă din timpuri străvechi şi cele mai faimoase dintre ele, diamantele, au devenit atât simbolul durităţii cât şi al eternităţii.
De altfel, multe ţesuturi biologice sunt moi şi oricine ştie că viaţa nu e eternă. Oricum, este posibil să izolezi moleculele vieţii, precum proteine şi să creşti cristale biologice din ele în laborator. Studiul despre creşterea biocristalelor a fost bazat – şi e bazat încă – pe o întreagă disciplină cunoscută drept cristalografia macromoleculară.
Cristale şi structură
Studiul ştiinţific asupra cristalelor minerale (cristalografia) a început la sfârşitul secolului al XVII-lea. La început a presupus descrierea şi măsurarea feţelor şi unghiurilor diferitelor structuri cristaline şi clasificarea lor din perspectiva caracteristicilor geometrice. Curând, cristalografii au propus ca geometria precisă observată la scară macroscopică să fie explicată de aranjamentul regulat al particulelor foarte mici (de fapt, atomi, molecule sau ioni), invizibile cu ochiul liber, chiar şi la microscop. Cu teoria atomică încă nedezvoltată, acest tipar a fost excesiv dezbătut în secolele XVIII – XIX, fără o concluzie definitivă.
O serie de progrese cruciale în fizică au revoluţionat felul în care privim problema acum:
- În 1895, W.C. Röntgen a descoperit razele X. Aceste raze au avut abilitatea extraordinară de a penetra obiecte şi corpuri, astfel relevând trăsăturile interne. Razele X au fost imediat aplicate în imagistica medicală, dar natura lor (de raze electromagnetice) a rămas o enigmă pentru următorii 17 ani.
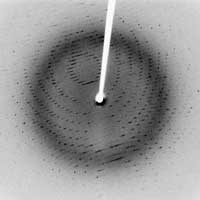
protezei cristalizate 3Clpro SARS
Imagine furnizata de Jeff Dahl;
sursa imaginii: Wikimedia Commons
- În 1912, Laue a descoperit difracţia razelor X, când a avut strălucita idee de a pune un cristal într-un fascicul de rază X. Într–un cristal, atomii sau moleculele sunt aranjate ordonat, repetând modelul în poziţii distincte: este o arie regulată a atomilor. De când atomii au acţionat ca raze X difuzate, aranjamentul regulat al atomilor în cristal produce interferenţe constructive ale razelor difuzate, care prin urmare sunt emise în direcţii specifice. Aceste raze emise sunt înregistrate pe un detector drept pete, iar imaginea rezultată se numeşte imagine de difracţie. Experimentul lui Laue a dovedit două lucruri: cristalele constau într-un aranjament foarte regulat al atomilor şi că razele X au o lungime de undă scurtă, de câteva zeci de nanometri – distanţa tipică dintre atomi.
- În 1913, familia Braggs – (tată şi fiu) au stabilit o relaţie – cunoscută ca legea Bragg (vezi Hughes, 2007, pentru o explicaţie mai amplă a legii Bragg) – dintre lungimea de undă (λ) a razelor X, distanţa (d) dintre două planuri atomice într-un cristal şi unghiul de incidenţă (θ) al razelor: 2 d sin θ = n λ, unde n este număr întreg. Această descoperire importantă a marcat începutul cristalografiei cu raze X, de exemplu posibilitatea de a descifra structura unui cristal expunându-l razelor X. Prima structură cu rezoluţie atomică pentru a fi “rezolvată” (în 1914) a fost a unei mase de sare, urmată repede de diamant. Impulsionat de acest succes timpuriu, tehnica foarte puternică de difracţie a razelor X a înzestrat oamenii de ştiinţă cu cheia spre înţelegerea şi clarificarea structurii atomice şi moleculare ale tuturor cristalelor. “A fost precum descoperirea unui câmp aluvial de aur cu pepită în jur aşteptând să fie adunată”, dupa cum Brag-ii înşişi recunosc.
În acelaşi timp, era crescut primul cristal biologic, făcându-se astfel posibil studiul biologic al moleculelor utilizând raze X. Prima imagine difractivă a proteinei, obţinută la începutul anilor 1930, a fost a unei enzime numite pepsină. Curând după aceea, cercetătorii au fost capabili să izoleze un virus, sa îl cristalizeze şi să arate că nu işi pierde vigoarea biologică, ca rezultat: virusul mozaicul tutunului era încă infecţios pentru tutun după cristalizare. Cristalografia macromoleculară era gata să înceapă!
Interesant e că nu doar un singur biolog a fost implicat în toată această cercetare timpurie a structurii moleculare complexe. A fost întru totul condusă de chimişti, fizicieni şi cristalografi, ţinând cont de faptul că în prima jumătate a secolului XX, mulţi cercetători din alte discipline s-au arătat interesaţi de biologie. Asta este cel mai bine reprezentată în cartea Ce e viaţa?, scrisă în 1944 de Erwin Schrödinger, un bine cunoscut fizician în domeniul mecanicii cuantice. Biologia moleculară, aparută în anii 1940 ca o combinaţie între biochimie şi genetică, a fost – de la începuturi – un domeniu interdisciplinar. Evident, această disciplină apărută a avut un ajutor imens de la instrumentele inovative create de fizicieni. Mai mult, pe un nivel conceptual, ideea că viaţa poate fi explicată prin simple mecanisme chimico – fizice a fost foarte controversată, iar complexitatea trăirii lumii nu putea fi redusă la interacţiuni dintre biomolecule după cum credeau unii. Astăzi, biologia structurii moleculare este recunoscută ca o ramură principală a biologiei şi încă se dezvoltă într-un ritm alert.
Se bazează puternic pe cristalografia macromoleculară, având avantajul că fiecare moleculă proteică are propriul strat de electroni, care difractă fasciculul razei X utilizat în cristalografie. Forma si mărimea stratului de electroni determină modelul în care razele X sunt difractatew2 – acestea semnalează molecula. Multe semnale slabe obţinute de la numere mari de proteine moleculare dintr-un cristal sunt adăugate unui semnal măsurabil.
Rezultatul imaginii difractate, luată din mai multe unghiuri rotind un cristal, este transformată matematic (operaţie numită transformare Fourier) într-o hartă a densităţii electronice a proteinei, care reprezintă stratul de electroni al proteinei. Cu ajutorul modelării computerizate şi a tehnicilor de selectie, porţiunea aminoacizilor din proteină, pot fi fixaţi în stratul de electroni pentru a determina aranjamenul tridimensional al atomilor în proteină, fiind structura finală.
Dar ce este această structură tridimensională atât de importantă pentru studiul proteinelor şi al altor molecule biologice?
Structura şi funcţia
Imagine apartinand lui geopaul/iStockphoto
Mâinile şi ochii noştri, precum alte trăsături anatomice ale regnurilor plantelor şi animalelor, au fost modelate pe tot parcursul evoluţiei pentru a întâmpina nevoile vieţii. În mod similar, structura microscopică a fiecărui organ subcelular şi macromolecule biologice este strâns legat de funcţiile sale. Moleculele cu formele potrivite sunt responsabile pentru apropierea şi depărtarea genelor, catalogând chimia complexă a vieţii, apărându-se împotriva invadării celulare şi înţelegând schimbările care iniţiază diviziunea celulei şi controlează dezvoltarea.
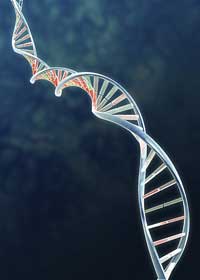
Importanţa structurii moleculare pentru înţelegerea unei funcţii este cel mai bine exemplificată, desigur, de ADN. Simplitatea şi frumuseţea dublu-helixului, structura bazelor pereche ale ADN-ului, a făcut imediat inteligibilă genetica în termeni chimici. Genele, în prealabil factori misterioşi care controlează succesiunea trăsăturilor particulare, erau segmente ale moleculelor de ADN care puteau fi extrase din soluţie la capătul baghetei de sticlă rotativă, precum vata de zahăr pe un băţ (vezi Madden, 2006, pentru o simplă extragere a ADN-ului într-o oră de laborator), producând astfel o fibră care poate fi studiată prin difracţia razelor X. Determinarea structurii de ADN remarcabile, dar simple, a reprezentat un pas important în biologia structurală.
O strâmtoare în genomica structurală: cristalizarea proteinei
În comparaţie cu genetica moleculară, progresul în cercetarea structurii proteinei a fost dureros de încet, parţial din cauza problemei tehnicii simple de a obţine cristale de proteină care sunt destul de mari să fie folosite pentru analize cristalografice şi să difracte razele X, suficient pentru a permite ca structura să fie determinată cu rezoluţia (atomică) înaltă. Mai mult, cu toate că ele arată precum cristalele moleculelor mici, precum cristalele sării de bucătărie, cristalele proteinei sunt mult mai mici şi în general foarte fragile.
proteine solubile in razele X. Nota:
structurile de cautare variaza in timp,
dupa cum unele devenite invechite su
fost inlaturate din baza de date.
Cristalizarea proteinei a fost în consecinţă, întotdeauna, o chestiune la întâmplare fără o teorie predictivă. Unele proteine au fost cristalizate uşor, altele au refuzat dur producerea cristalelor corespunzătoare; unele investigaţii au părut să aibă „degete verzi”, precum grădinarii buni şi să poată creşte cristale unde altele au eşuat. Ca rezultat, cristalizarea de proteine a fost alte ori simţită a fi mai mult o artă decât o ştiinţă.
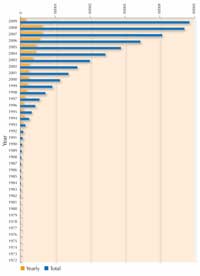
Pentru fiecare nouă proteină, oamenii de ştiinţă trebuie să afişeze un număr mare de condiţii pentru a găsi circumstanţele particulare sub care se vor cristaliza. Variabilele care pot fi schimbate în aceste condiţii sunt, de exemplu, concentraţia proteinei, temperatura, pH-ul şi concentraţiile unei mari varietăţii de agenţi de precipitare care pot fi utilizate în combinaţii cu diferite săruri. Pentru a testa cel mai bine condiţiile pentru cristalizarea unei proteine într-un experiment la o oră de curs şi pentru a avea rezultatele analizate de difracţia razelor X într-un laborator de cristalografie real, vezi Blattmann & Sticher (2009) în această problemă. Deoarece cristalizarea proteinei a pus atât de multe probleme, până recent cele mai multe proteine studiate au fost cele care se cristalizau uşor şi care pot fi produse în cantităţi mari, mai degrabă decât cele mai importante. Oricum, multe progrese au fost făcute în ultimul deceniu, după cum poate fi văzut în figura care arată creşterea numărului de structuri proteice rezolvate de cristalografia prin raze X începând cu anul 1983. Progresul spectaculos este datorat tehnicilor îmbunătăţite în trei zone: prepararea cristalului, cristalografia în sincrotonul cu raze X şi dezvoltarea software-ului.
Călătoria unei proteine de la un laborator la altul
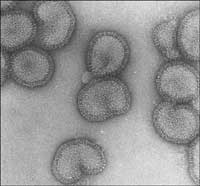
microscopul ectronic
Imagine furnizata de Rob
Ruigrok/ UVHCI
Pentru a arăta cum structura unei proteine este soluţionată folosind cele mai dezvoltate instrumente ale zilelor de azi, vom privi la cum identifică cercetătorii structura proteinei polimeraza din virusul gripal. Un grup de oameni de ştiinţă de la Laboratorul European de Biologie Moleculară (EMBL Grenoble outstationw3, Franţa) şi de la Unit of Virus Host-Cell Interactionw4 (UVHCI, Grenoble) au studiat această proteină, care este implicată în mecanismul utilizat de virus pentru a prelua controlul asupra proceselor din celulele umane pe care le infectează (vezi Ainsworth, 2009, în această problemă, pentru detalii asupra studiului şi rezultatelor sale). Pentru acest proiect, cercetătorii s-au folosit de ,,Parteneriatul pentru biologia structuralw5 (PSB), o colaborare pentru a descifra structura moleculelor biologice de interes medical ridicat.
Clonarea şi exprimarea (la UVHCI, LEBM şi PBS)
Odată ce proteina a fost selectată pentru studiu, gena sa corespondentă a fost amplificată, de exemplu clonată într-un sistem special de exprimare. Asta permite producerea cantităţilor mari de proteină folosind un sistem gazdă, de obicei o bacterie.
Purificarea (la PSB) şi calitatea evaluării (la IBS)
Celulele bacteriene au fost “recoltate” prin centrifugare, iar resturile celulare şi posibile substanţe contaminante precum acizii nucleici au fost îndepărtate. Proteina a fost apoi supusă unui proces de purificare în mai mulţi paşi, lung, dar crucial, pentru a obţine o puritate de cel puţin 95%, dorită pentru cristalizare. Calitatea proteinei a fost evaluată la Institutul de Biologie Structurală Jean-Pierre Ebelw6 (IBS) prin spectrometrie de masă (pentru o scurtă introducere în specrometria de masă, vezi Wilson & Haslam, 2009, iar un secvenţiator fost folosit pentru a verifica dacă proteina purificată este cea dorită: polimeraza virusului gripal.
Cristalizarea (la PBS)
Cercetătorii au început să încerce cristalizarea proteinei folosind analize multifactoriale. Cu alte cuvinte, au expus concentraţii diferite ale unei proteine la diferiţi agenţi de cristalizare, soluţii tampon, temperaturi şi aşa mai departe. Cunoscută ca metoda microamestecului (vezi imaginea următoare) ea este dezvoltată pentru a obţine informaţii maxime asupra proteinei dorită să cristalizeze în timp ce utilizează o cantitate minimă din mostră.
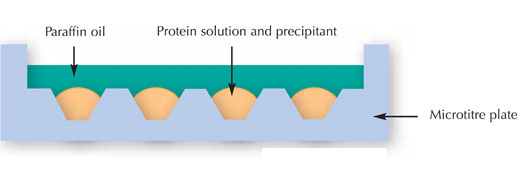
Imagine furnizata de Nicola Graf
Difracţia cu raze X a unei raze sincrotonale şi colectarea datelor (la ESRF)

Imagine furnizata de ESRF

un fascicul la ESRF
Imagine furnizata de ESRF
Odată obţinute cristalele de polimerază, cercetătorii le-au conservat criogenându-le cu nitrogen lichid şi transportându-le pentru a fi iradiate la Instalaţia Europeană de Radiaţie Sincrotonală (ERSF)w1. Acolo, cristalele au fost fixate în vârful unui gonimetru – asta o face de obicei un robot – şi expuse la razele X sincrotonale, care sunt foarte intense. Un gonimetru e un instrument care permite unui obiect, precum un cristal, să fie rotit într-o poziţie unghiulară precisă.
Capul gonimetrului e rotit în fasciculul razei X, cu scopul de a produce un număr maxim de reflexii. Asta produce cantităţi enorme de informaţii, tipic pentru colecţii de date de la surse sincrotonale, deci structura actuală a proteinei a fost determinată automat, folosind un ansamblu de pachete de programe special dezvoltate în acest scop.
Construirea modelului, aranjarea hărţii, finisarea şi validarea (la UVHCI şi EMBL)
Bazat pe colectarea şi procesarea datelor, un model atomic de polimerază a fost construit şi comparat cu harta densităţii electronului. Modelul a fost atunci rafinat pentru a se potrivi mai bine datelor observate, datorită soft-ului şi interactivităţii moleculare grafice. După validarea modelului, structura a fost în sfârşit publicată şi depusă pentru accesul publicului la Banca de Date ale Proteinelorw7.
ERSF-ul: una din cele mai intense surse de raze X din lume
ESRF-ul este un exemplu bun de vaste facilităţi operaţionale ziua şi noaptea pentru binele utilizatorilor din toată lumea. Un “utilizator” e un om de ştiinţă, de obicei parte a unei echipe mai mari, care are nevoie ocazional de un instrument puternic pentru a obţine informaţii asupra unei probe de interes (o bucată de material, un cristal de proteină, o fosilă sau o reacţie catalitică de pildă). Majoritatea utilizatorilor călătoresc spre Grenoble de câteva ori pe an pentru a culege date la ESRF.

Radiaţie Sincrotonală
Imagine furnizata de P. Ginter/ESRF
Ca sursă de a treia generaţie, ERSF produce raze X extrem de intense, numite radiaţii sincrotonale. Aceste fascicule sunt emise de electroni de înaltă-energie (6GeV) care circulă într-un larg “inel de depozitare”, masurând 844 metri în circumferinţă. Razele X sincrotonale sunt foarte colimate, într-un fel ca fasciculele laser (razele luminii colimate sunt aproape paralele).
Fasciculele razei X sunt direcţionate spre liniile de radiaţii, care înconjoară inelul de depozitare în sala de experimente. Fiecare dintre cele 42 de linii de radiaţii, la IERS este specializată pe tehnici specifice sau tipuri de cercetare. Pentru aproximativ 10 dintre ele specialitatea o constituie cristalele de proteină. Liniile de radiaţii la ERSF devin din ce în ce mai automatizate, uşurând folosirea lor şi garantând de curând cercetătorilor accesul la controlul de la distanţă. Asta le permite utilizatorilor să conducă experimentele lor sincrotonale fară sa mai părăsească propriul laborator. Cristalele sunt transportate mai degrabă, decât duse personal la ERSF, chiar dacă cercetătorii merg ei înşişi acolo, pentru că restricţiile de securitate curente face dificilă călătoria cu mostre biologice sensibile.
Radiaţia sincrotonală explică aproape 80% din structura macromoleculară a cristalului, depozitată în Banca de Date a Proteineiw7 (în 1995, doar 17% din acestea au venit de la informaţii sincrotonale, vezi imaginea alăturată). ERSF produce cam 20% din acest total.
References
- Ainsworth C (2009) Outmanoeuvering influenza’s tricks. Science in School 11: 25-29.
- Blattmann B, Sticher P (2009) Growing crystals from protein. Science in School 11: 30-36.
- Hughes D (2007) Taking the stress out of engineering. Science in School 5: 61-65.
- Madden D (2006) Discovering DNA. Science in School 1: 34-36.
- Schrödinger E (1944) What is Life? Cambridge, UK: Cambridge University Press
- Wilson A, Haslam S (2009) Sugary insights into worm parasite infections. Science in School 11: 20-24.
Web References
- w1 – For more information on the ESRF, see: www.esrf.eu
- w2 – More information on the theory of protein crystallisation and X-ray diffraction can be found here: www-structmed.cimr.cam.ac.uk/Course
- w3 – To find out more about the EMBL outstation in Grenoble, see: www.embl.fr
- w4 – To learn more about the Unit for Virus Host Cell Interaction, see: www.uvhci.fr
- w5 – The Partnership for Structural Biology (PSB) is a collaboration between EMBL, the Institut de Biologie Structurale, ESRF and the Institut Laue-Langevin – the world’s leading neutron source. The PSB provides an integrated structural biology environment with a portfolio of state-of-the-art techniques on one site: cloning and expression, crystal production, physico-chemical-biochemical characterisation, X-ray and neutron crystallography, nuclear magnetic resonance (NMR), electron microscopy and tomography, small angle X-ray and neutron scattering, mass spectroscopy and advanced light microscopy. See: www.psb-grenoble.eu
- w6 – To find out more about the IBS, see: www.ibs.fr
- w7 – For the website of the Protein Data Bank, see: www.rcsb.org/pdb
Resources
- Abad-Zapatero C (2002) Crystals and Life: A Personal Journey. La Jolla, CA, USA: International University Line. ISBN: 9780972077408
- Blow D (2002) Outline of Crystallography for Biologists. Oxford, UK: Oxford University Press
- Branden C, Tooze J (1991) Introduction to Protein Structure. New York, NY, USA: Garland
- Michette A, Pfauntsch S (1996) X-rays: the first hundred years. Chichester, UK: John Wiley & Sons
- Wood EA (1972) Crystals – A Handbook for School Teachers. Chester, UK: International Union of Crystallography
- For a website with crystal growing experiments, see: www.sciencecompany.com/sci-exper
- For the website of the International Union of Crystallography, see: www.iucr.org
